Як порахувати нижчий ступінь окиснення. Ступені окислення – це яка величина? Як визначити ступінь окислення елементів?
Такий предмет шкільної програмияк хімія викликає багато труднощів у більшості сучасних школярів, мало хто може визначити ступінь окислення в сполуках. Найбільші складнощі у школярів, які вивчають неорганічну хімію, тобто учнів основної школи (8-9 класи). Нерозуміння предмета призводить до виникнення неприязні у школярів до цього предмета.
Педагоги виділяють цілу низку причин такої «нелюбові» учнів середніх і старших класів до хімії: небажання розумітися на складних хімічних термінах, невміння користуватися алгоритмами для розгляду конкретного процесу, проблеми з математичними знаннями. Міністерством освіти РФ було внесено серйозні зміни у зміст предмета. До того ж, "урізали" і кількість годин на викладання хімії. Це негативно позначилося якості знань з предмету, зниження інтересу до вивчення дисципліни.
Які теми курсу хімії даються школярам найважче?
за новій програмідо курсу навчальної дисципліни «Хімія» основної школи включено кілька серйозних тем: періодична таблиця елементів Д. І. Менделєєва, класи неорганічних речовин, іонний обмін. Найважче дається восьмикласникам визначення оксидів.
Правила розміщення
Насамперед учні повинні знати, що оксиди є складними двоелементними сполуками, до складу яких включено кисень. Обов'язковою умовоюПриналежності бінарної сполуки до класу оксидів є розташування кисню другим у даній сполукі.
Алгоритм для кислотних оксидів
Спочатку зауважимо, що ступеня окислення це чисельні вирази валентності елементів. утворені неметалами або металами з валентністю від чотирьох до семи, другим у таких оксидах обов'язково стоїть кисень.
В оксидах валентність кисню завжди відповідає двом, визначити її можна за періодичною таблицею елементів Д. І. Менделєєва. Такий типовий неметал як кисень, перебуваючи у 6 групі головної підгрупи таблиці Менделєєва, приймає два електрони, щоб повністю завершити свій зовнішній енергетичний рівень. Неметали у сполуках з киснем найчастіше виявляють найвищу валентність, що відповідає номеру самої групи. Ступінь нагадати, що ступінь окислення хімічних елементів це показник, що передбачає позитивне (негативне) число.
Неметал, що стоїть на початку формули, має позитивний ступінь окислення. Неметал кисень в оксидах стабільний, його показник -2. Для того щоб перевірити достовірність розміщення значень у кислотних оксидах, доведеться перемножити всі поставлені вами цифри на індекси у конкретного елемента. Розрахунки вважаються достовірними, якщо сумарний результат всіх плюсів і мінусів поставлених ступенів виходить 0.

Складання двоелементних формул
Ступінь окислення атомів елементів дає шанс створювати та записувати з'єднання з двох елементів. При створенні формули для початку обидва символи прописують поруч, обов'язково другим ставлять кисень. Зверху над кожним із записаних знаків прописують значення ступенів окислення, потім між знайденими числами знаходиться те число, що без будь-якого залишку ділитися на обидві цифри. Даний показник необхідно розділити окремо на числове значення ступеня окислення, отримуючи індекси першого і другого компонентів двоелементного речовини. Вища ступінь окислення дорівнює чисельно значенню вищої валентності типового неметалу, ідентична номеру групи, де стоїть неметал у ПС.
Алгоритм встановлення числових значень в основних оксидах
Подібними сполуками вважаються оксиди типових металів. Вони у всіх сполуках мають показник ступеня окислення трохи більше +1 чи +2. Для того щоб зрозуміти, який буде мати ступінь окислення металу, можна скористатися періодичною системою. У металів основних підгруп першої групи даний параметр завжди постійний, він аналогічний номеру групи, тобто +1.
Метали основної підгрупи другої групи також характеризуються стабільним ступенем окислення у цифровому вираженні +2. Ступені окислення оксидів у сумі з урахуванням їх індексів (числа) повинні давати нуль, оскільки хімічна молекула вважається нейтральною, позбавленою заряду, часткою.
Розстановка ступенів окислення в кисневмісних кислотах
Кислоти є складними речовинами, що складаються з одного або декількох атомів водню, які пов'язані з якимось кислотним залишком. Враховуючи, що ступеня окислення це цифрові показники, їх обчислення знадобляться деякі математичні навички. Такий показник для водню (протону) у кислотах завжди стабільний, становить +1. Далі можна вказати ступінь окислення для негативного іона кисню, вона також стабільна -2.
Тільки після цих процесів, можна обчислювати ступінь окислення у центрального компонента формули. Як конкретний зразок розглянемо визначення ступеня окислення елементів у сірчаній кислоті H2SO4. Враховуючи, що в молекулі цієї складної речовини міститься два протони водню, 4 атоми кисню, отримуємо вираз такого виду +2+X-8=0. Для того щоб у сумі утворювався нуль, сірка матиме ступінь окислення +6
Розташування ступенів окиснення в солях
Солі є складні сполуки, які з іонів металу і однієї чи кількох кислотних залишків. Методика визначення ступенів окислення у кожного з складових частину складній солі така ж, як і в кисневмісних кислотах. Враховуючи, що рівень окислення елементів - це цифровий показник, важливо правильно позначити рівень окислення металу.
Якщо метал, що утворює сіль, розташовується в головній підгрупі, його ступінь окислення буде стабільним, відповідає номеру групи, є позитивною величиною. Якщо ж у солі міститься метал подібної підгрупи ПС, який виявляє різні метали можна за кислотним залишком. Після того як встановлена ступінь окислення металу, ставлять (-2), далі обчислюють ступінь окислення центрального елемента, скориставшись хімічним рівнянням.
Як приклад розглянемо визначення ступенів окислення у елементів (середньої солі). NaNO3. Сіль утворена металом головної підгрупи 1 групи, отже, ступінь окислення натрію буде +1. У кисню в нітратах ступінь окиснення становить -2. Для визначення чисельного значення ступеня окиснення становить рівняння +1+X-6=0. Вирішуючи дане рівняння, отримуємо, що X має бути +5, це і є

Основні терміни в ОВР
Для окислювального, і навіть відновлювального процесу є спеціальні терміни, які мають вивчити школярі.
Ступінь окислення атома - це його безпосередня здатність приєднувати до себе (віддавати іншим) електрони від якихось іонів або атомів.
Окислювачем вважають нейтральні атоми чи заряджені іони, під час хімічної реакціїелектрони, що приєднують собі електрони.
Відновником стануть незаряджені атоми чи заряджені іони, що у процесі хімічної взаємодії втрачають власні електрони.
Окислення представляється як процедура віддачі електронів.
Відновлення пов'язані з прийняттям додаткових електронів незарядженим атомом чи іоном.
Окисно-відновним процесом характеризується реакція, в ході якої обов'язково змінюється ступінь окислення атома. Це визначення дозволяє зрозуміти, як визначити, чи є реакція ОВР.

Правила розбору ОВР
Користуючись цим алгоритмом, можна розставити коефіцієнти у будь-якій хімічній реакції.
Останнім етапом буде розстановка стереохімічних коефіцієнтів у аналізованій реакції.
Приклад ОВР
Для початку потрібно розставити в кожній хімічній речовині ступеня окиснення. Врахуйте, що ступінь окислення дорівнює нулю, оскільки відсутня віддача (приєднання) негативних частинок. Правила розстановки ступенів окислення в бінарних та триелементних речовин були нами розглянуті вище.
Потім необхідно визначити ті атоми чи іони, які у ході перетворення, змінилися ступеня окислення.
З лівої частини записаного рівняння виділяють атоми чи заряджені іони, які змінили свої ступені окислення. Це потрібно складання балансу. Над елементами обов'язково вказують їх значення.
Далі записуються ті атоми чи іони, які утворилися під час реакції, вказується знаком + кількість прийнятих атомом електронів, - кількість відданих негативних часток. Якщо після взаємодії зменшуються ступеня окислення. Це означає, що електрони було прийнято атомом (іоном). У разі підвищення ступеня окислення атом (іон) у ході реакції віддають електрони.
Найменше загальна кількістьділять спочатку на прийняті, потім віддані в процесі електрони, отримують коефіцієнти. Знайдені цифри будуть шуканими стереохімічними коефіцієнтами.
Визначають окислювач, відновник, процеси, що протікають під час реакції.
Розглянемо практичне застосуванняданого алгоритму на конкретній хімічній реакції.
Fe+CuSO4=Cu+FeSO4
Розраховуємо показники у всіх простих та складних речовин.
Так як Fe і Cu є простими речовинами, їх ступінь окислення дорівнює 0. CuSO4, то Cu+2, тоді у кисню-2, а у сірки +6. FeSO4: Fe +2, отже, для О-2, за розрахунками S +6.
Тепер шукаємо елементи, що змогли змінити показники, у нашій ситуації ними виявляться Fe та Cu.
Так як після реакції значення у атома заліза стала +2, реакції було віддано 2 електрона. Мідь змінила свої показники з +2 до 0, отже, мідь прийняла 2 електрони. Тепер визначаємо кількість прийнятих та відданих електронів атомом заліза та катіоном двовалентної міді. У ході перетворення взято два електрони катіоном двовалентної міді, стільки ж електронів віддано атомом заліза.
У цьому процесі немає сенсу визначати мінімальне загальне кратне, оскільки прийнято та віддано в ході перетворення рівну кількість електронів. Стереохімічні коефіцієнти також відповідатимуть одиниці. У реакції властивості відновника виявлятиме залізо, при цьому воно окислюється. Катіон двовалентної міді відновлюється до чистої міді, реакції у неї найвищий ступіньокиснення.

Застосування процесів
Формули ступеня окислення повинні бути відомі кожному школяру 8-9 класу, оскільки це питання включено в завдання ОДЕ. Будь-які процеси, які протікають з окислювальними, відновлювальними ознаками, грають важливе значенняу нашому житті. Без них неможливі обмінні процеси в організмі людини.
Частина I
1. Ступінь окислення (с. о.) – цеумовний заряд атомів хімічного елемента у складному речовині, обчислений з урахуванням припущення, що складається з простих іонів.
Слід знати!
1) У з'єднаннях с. о. водню = +1, крім гідридів.
2) У з'єднаннях с. о. кисню = -2, крім пероксидів ![]() та фторидів
та фторидів
3) Ступінь окиснення металів завжди позитивна.
Для металів головних підгруп перших трьохгруп с. о. постійна:
метали ІА групи - с. о. = +1,
метали IIA групи – с. о. = +2,
метали IIIA групи – с. о. = +3.
4) У вільних атомів та простих речовин с. о. = 0.
5) Сумарна с. о. всіх елементів у поєднанні = 0.
2. Спосіб утворення назвдвоелементних (бінарних) з'єднань.

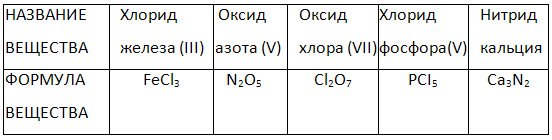
4. Доповніть таблицю «Назви та формули бінарних сполук».
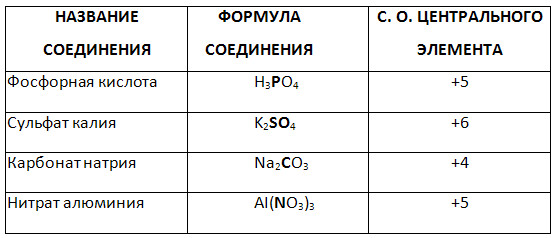
5. Визначте рівень окислення виділеного шрифтом елемента складного з'єднання.
Частина II
1. Визначте ступеня окиснення хімічних елементів у сполуках за їх формулами. Напишіть назви цих речовин.

2. Розділіть речовини FeO, Fe2O3, CaCl2, AlBr3, CuO, K2O, BaCl2, SO3на дві групи. Запишіть назви речовин, вказавши ступінь окислення.

3. Встановіть відповідність між назвою та ступенем окислення атома хімічного елемента та формулою сполуки.

4. Складіть формули речовин за назвою.

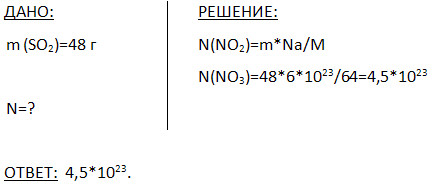
5. Скільки молекул міститься в 48 г оксиду сірки (IV)?
6. За допомогою Інтернету та інших джерел інформації підготуйте повідомлення про застосування будь-якого бінарного з'єднання за таким планом:
1) формула;
2) назву;
3) властивості;
4) застосування.
Вода H2O, оксид водню.
Вода при звичайних умовахрідина, без кольору, запаху, у товстому шарі – блакитна. Температура кипіння близько 100? Є гарним розчинником. Складається молекула води з двох атомів водню та одного атома кисню, це його якісний та кількісний склад. Ця складна речовина, для неї характерні наступні хімічні властивості: взаємодія із лужними металами, лужноземельними металами. Реакції обміну із водою називаються гідролізом. Ці реакції мають велике значенняу хімії.
7. Ступінь окислення марганцю у поєднанні К2МnO4 дорівнює:
3) +6
8. Найменший ступінь окислення хром має у поєднанні, формула якого:
1) Сг2O3
9. Максимальний ступінь окислення хлор виявляє у поєднанні, формула якого:
3) Сl2O7
Як визначити ступінь окиснення? Таблиця Менделєєва дозволяє записувати цю кількісну величину будь-якого хімічного елемента.
Визначення
Для початку спробуємо зрозуміти, що є даний термін. Ступінь окислення по таблиці Менделєєва є кількість електронів, які прийняті чи віддані елементом у процесі хімічної взаємодії. Вона може приймати негативне та позитивне значення.
Зв'язок із таблицею
Як визначається ступінь окиснення? Таблиця Менделєєва складається із восьми груп, розташованих вертикально. У кожній з них є дві підгрупи: головна та побічна. Щоб встановити показники для елементів, необхідно використовувати певні правила.
Інструкція
Як розрахувати ступеня окиснення елементів? Таблиця дозволяє повною мірою впоратися з такою проблемою. Лужні метали, які розташовуються у першій групі (головній підгрупі), ступінь окислення виявляють у сполуках, вона відповідає +, що дорівнює їх вищій валентності. У металів другої групи (підгрупи А) +2 ступінь окиснення.
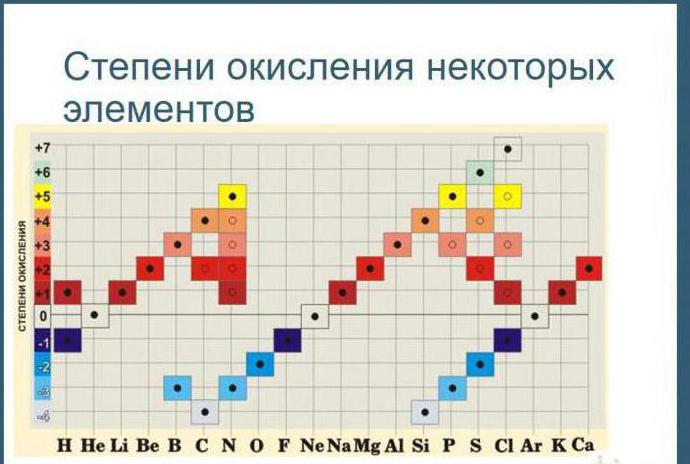
Таблиця дозволяє визначити цю величину не тільки у елементів, що виявляють металеві властивості, а й у неметалів. Їх максимальна величина буде відповідати найвищій валентності. Наприклад, для сірки вона становитиме +6, для азоту +5. Як обчислюється мінімальна (нижча) цифра? Таблиця відповідає і це питання. Необхідно відняти номер групи з восьми. Наприклад, у кисню вона становитиме -2, у азоту -3.
Для простих речовин, які не вступали в хімічну взаємодію з іншими речовинами, показник вважається рівним нулю.
Спробуємо виявити основні дії щодо розстановки в бінарних сполуках. Як поставити в них рівень окислення? Таблиця Менделєєва допомагає вирішити проблему.
Наприклад візьмемо оксид кальцію СаО. Для кальцію, розташованого в головній підгрупі другої групи, величина буде постійною, рівною +2. У кисню, що має неметалеві властивості, цей показник буде негативною величиною, і він відповідає -2. Щоб перевірити правильність визначення, підсумовуємо отримані цифри. У результаті отримаємо нуль, отже, обчислення правильні.
Визначимо такі показники ще в одному бінарному з'єднанні CuO. Так як мідь розташовується в побічній підгрупі (першій групі), отже, показник, що вивчається, може проявляти різні значення. Тому для визначення необхідно спочатку виявити показник для кисню.
У неметалу, що розташовується наприкінці бінарної формули, ступінь окислення має негативне значення. Так як цей елемент знаходиться в шостій групі, при відніманні з восьми шести отримуємо, що ступінь окислення у кисню відповідає -2. Так як у поєднанні відсутні індекси, отже, показник ступеня окиснення у міді буде позитивним, рівним +2.
Як використовується хімічна таблиця? Ступені окислення елементів у формулах, що складаються з трьох елементів, також обчислюються за певним алгоритмом. Спочатку розставляють ці показники у першого та останнього елемента. Для першого цей показник матиме позитивне значення, відповідатиме валентності. У крайнього елемента, як якого виступає неметал, даний показник має негативне значення, він визначається у вигляді різниці (від восьми віднімають номер групи). При обчисленні ступеня окислення центрального елемента використовують математичне рівняння. При розрахунках враховують індекси, що є у кожного елемента. Сума всіх ступенів окислення повинна дорівнювати нулю.
Приклад визначення у сірчаній кислоті
Формула цієї сполуки має вигляд H 2 SO 4 . У водню ступінь окислення становитиме +1, у кисню вона дорівнює -2. Для визначення ступеня окислення у сірки складемо математичне рівняння: + 1 * 2 + Х + 4 * (-2) = 0. Отримуємо, що ступінь окислення у сірки відповідає +6.
Висновок
З використанням правил можна розставляти коефіцієнти в окислювально-відновних реакціях. Це питання розглядається в курсі хімії дев'ятого класу шкільної програми. Крім того, інформація про ступені окислення дозволяє виконувати завдання ОГЕ та ЄДІ.
Ступінь окиснення. Визначення ступеня окиснення атома елемента за хімічною формулою сполуки. Складання формули сполуки за відомими ступенями окислення атомів елементів
Ступінь окислення елемента - це умовний заряд атома в речовині, обчислений з припущенням, що вона складається з іонів. Для визначення ступеня окиснення елементів необхідно запам'ятати певні правила:
1. Ступінь окислення може бути позитивним, негативним або рівним нулю. Він позначається арабською цифроюзі знаком плюс або мінус над символом елемента.
2. При визначенні ступенів окислення виходять з електронегативності речовини: сума ступенів окислення всіх атомів у поєднанні дорівнює нулю.
3. Якщо з'єднання утворено атомами одного елемента (у простій речовині), то ступінь окислення цих атомів дорівнює нулю.
4. Атомам деяких хімічних елементів зазвичай приписують сталі ступеня окиснення. Наприклад, ступінь окислення фтору в з'єднаннях завжди дорівнює -1; літію, натрію, калію, рубідії та цезію +1; магнію, кальцію, стронцію, барію та цинку +2, алюмінію +3.
5. Ступінь окиснення водню в більшості сполук +1, і тільки в з'єднаннях з деякими металами він дорівнює -1 (KH, BaH 2).
6. Ступінь окислення кисню в більшості сполук -2, і лише в деяких сполуках йому приписують ступінь окислення -1 (H 2 O 2 Na 2 O 2 або +2 (OF 2).
7. Атоми багатьох хімічних елементів надають змінні ступені окислення.
8. Ступінь окислення атома металу в сполуках позитивний і чисельно дорівнює його валентності.
9. Максимальний позитивний ступінь окислення елемента, як правило, дорівнює номеру групи в періодичній системі, де знаходиться елемент.
10. Мінімальний ступінь окиснення для металів дорівнює нулю. Для неметалів здебільшого нижче негативний ступінь окислення дорівнює різниці між номером групи та цифрою вісім.
11. Ступінь окислення атома утворює простий іон (складається з одного атома), що дорівнює заряду цього іона.
Користуючись наведеними правилами, визначимо ступеня окиснення хімічних елементів у складі H 2 SO 4 . Це складна речовина, що складається з трьох хімічних елементів - водню Н, сірки S та кисню О. Зазначимо ступеня окиснення тих елементів, для яких вони є постійними. У нашому випадку це водень Н та кисень О:.
Визначимо невідомий ступінь окислення сірки. Нехай ступінь окислення сірки у цій сполукі дорівнює х:.
Складемо рівняння, помноживши для кожного елемента його індекс у ступінь окислення та добуту суму прирівняємо до нуля: 2 · (+1) + x + 4 · (-2) = 0
Отже, ступінь окислення сірки дорівнює плюс шість:.
У наступному прикладі з'ясуємо, як можна скласти формулу з'єднання з відомими ступенямиокиснення атомів елементів. Складемо формулу ферум (III) оксиду. Слово «оксид» означає, що з символу заліза треба записати символ кисню: FeO.
Зазначимо ступеня окиснення хімічних елементів над їх символами. Ступінь окиснення заліза вказана в назві в дужках (III), отже, дорівнює +3, ступінь окиснення кисню в оксидах -2:.
Знайдемо найменше загальне кратне для чисел 3 та 2, це 6. Розділимо число 6 на 3, отримаємо число 2 – це індекс для заліза. Розділимо число 6 на 2, отримаємо число 3 – це індекс для кисню:.
У наступному прикладі з'ясуємо, як можна скласти формулу сполуки з відомими ступенями окиснення атомів елементів та зарядами іонів. Складемо формулу кальцій ортофосфату. Слово «ортофосфат» означає, що праворуч від символу Кальцію треба записати кислотний залишок ортофосфатної кислоти: CaPO 4 .
Зазначимо ступінь окислення кальцію (правило номер чотири) та заряд кислотного залишку (по таблиці розчинності):.
Знайдемо найменше загальне кратне для чисел 2 та 3, це 6. Розділимо число 6 на 2, отримаємо число 3 – це індекс для кальцію. Розділимо число 6 на 3, отримаємо число 2 - це індекс кислотного залишку:.
Кристалічні грати
Кристалічні грати. Атомні, молекулярні та іонні кристали. Залежність фізичних властивостей речовин від типів кристалічних ґрат
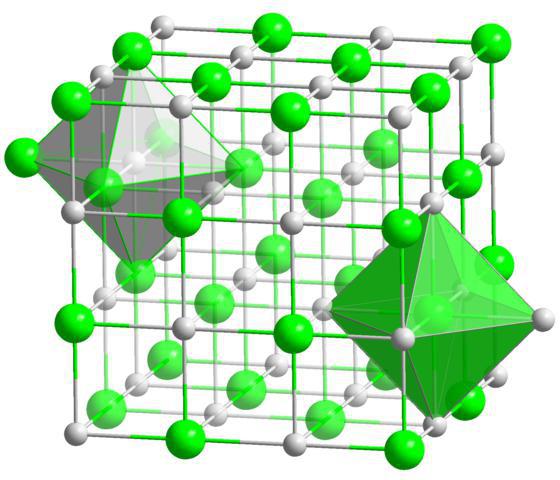
У кристалічних речовин атоми, молекули та іони розташовані впорядковано, на певних відстанях. Таке закономірне розташування частинок у кристалах називають кристалічною решіткою. Залежно від того, які частинки знаходяться у вузлах цієї решітки, розрізняють іонні, атомні та молекулярні кристалічні решітки. Відомі також металеві кристалічні решітки.
Іонні кристалічні ґрати характерні для сполук із іонним типом хімічного зв'язку. У вузлах таких ґрат знаходяться протилежно заряджені іони. Сили мижионной взаємодії є дуже значними, тому речовини з таким типом кристалічних ґрат є нелетючими, твердими, тугоплавкими, їх розчини і розплави проводять електричний струм. Типовими представникамитаких сполук є солі, наприклад, хлорид натрію, калію нітрат та інші.
Атомні кристалічні решітки характерні для сполук із ковалентним типом хімічного зв'язку. У вузлах таких ґрат знаходяться окремі атоми, пов'язані ковалентними зв'язками. Всі зв'язки рівноцінні і міцними, тому речовини з таким типом кристалічних ґрат характеризуються великою твердістю, високими температурамиплавлення, хімічна інертність. Такий тип кристалічних ґрат характерно для алмазу, кремній (IV) оксиду, бору.
Молекулярні кристалічні решітки характерні для сполук із ковалентним типом хімічного зв'язку. У вузлах таких ґрат знаходяться неполярні або полярні молекули. Внаслідок слабких сил взаємодії речовини з таким типом кристалічних ґрат мають незначну твердість, низькі температури плавлення та кипіння, характеризуються леткістю. Такий тип кристалічних ґрат характерно для кисню, йоду, води, глюкози, спиртів, нафталіну.
Таким чином, існує певний зв'язок між типом кристалічних ґрат і фізичними властивостямиречовини. Тому, якщо відома будова речовини, можна прогнозувати її властивості і, навпаки, якщо відомі властивості речовини, можна визначити її будову.
Ковалентний зв'язок, його види - полярний та неполярний
Ковалентний зв'язок, його види - полярний та неполярний. Освіта ковалентного неполярного зв'язку. Освіта ковалентного полярного зв'язку. Електронні формули молекул речовин
Ковалентний зв'язок- це хімічна зв'язок, що утворюється з допомогою загальних електронних пар.
Розглянемо механізм утворення ковалентного зв'язку з прикладу молекули водню H 2 . Атоми водню мають електронну формулу: 1 H 1s 1 .
При зближенні двох атомів водню відбувається взаємодія двох електронів з антипаралельними спинами (позначаються електрони стрілками з різних напрямків) із формуванням загальної (поділеної) електронної пари.
Схему утворення ковалентного зв'язку можна уявити, позначаючи неспарений електрон зовнішнього рівня однією точкою, а загальну електронну пару - двома точками. Спільну електронну пару, тобто. ковалентний зв'язок, часто позначають рисою. Загальна електронна пара утворюється в результаті перекриття s-орбіталей атомів водню, при цьому в області перекривання орбіталей створюється підвищена щільність електронна.
Розглянемо утворення ковалентного зв'язку у молекулі хлору Cl2. Атоми хлору мають електронну формулу: 17 Cl 1s 2 2s 2 2p 6 3s 2 3p 5 .
Атом хлору має сім електронів на зовнішньому енергетичному рівні, причому на 3p – підрівні знаходиться один неспарений електрон. При зближенні двох атомів хлору відбувається перекриття 3p - орбіталей з неспареними електронами та утворення загальної електронної пари. Кожен атом хлору в молекулі Cl 2 зберігає три нерозділені електронні пари (які належать одному атому).
У молекулі водню H2, як і молекулі хлору Cl 2 , утворюється простий (одинарний) зв'язок. Існують молекули, у яких між двома атомами виникають дві чи три електронні пари. Такі ковалентні зв'язки називають, відповідно, подвійними чи потрійними. Загальна назва подвійних та потрійних зв'язків – кратні зв'язки.
Наприклад, розглянемо утворення ковалентного зв'язку в молекулі кисню O2. Атоми кисню мають електронну формулу: 8 O 1s 2 2s 2 2p 4 .
Атом кисню має шість електронів на зовнішньому енергетичному рівні, причому на 2p - підрівні знаходиться два неспарені електрони. В утворенні хімічного зв'язку в молекулі O 2 беруть участь по два електрони кожного атома кисню. У даному випадкуутворюються дві загальні електронні пари (подвійний зв'язок). Кожен атом кисню в молекулі O 2 зберігає дві нерозділені електронні пари.
При утворенні ковалентного зв'язку в молекулі водню кожен з атомів водню є стійкою двоелектронною конфігурацією за рахунок утворення загальної електронної пари. В інших випадках при утворенні ковалентного зв'язку, наприклад, молекулах хлору і кисню кожен з атомів є стійкою конфігурації, що складається з восьми електронів.
У разі всіх трьох розглянутих молекул (водню, хлору та кисню) ковалентний зв'язок утворився між атомами з однаковою електронегативністю. Така взаємодія спостерігається при утворенні простих речовин-неметалів, молекули яких складаються з двох однакових атомів. І тут загальні електронні пари розташовуються симетрично між ядрами атомів, з'єднуються. Внаслідок цього утворюються молекули, у яких центри позитивних та негативних зарядів збігаються.
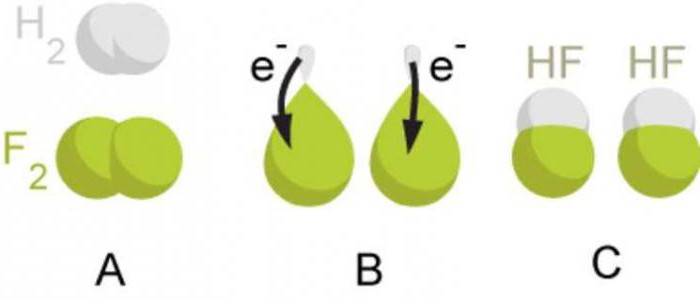
Отже, ковалентний зв'язок, який утворюється між атомами з однаковою електронегативністю за рахунок загальних електронних пар, називають ковалентним неполярним зв'язком. Треба запам'ятати, що такий тип хімічного зв'язку утворюється у простих речовин-неметалів. Як приклади речовин з ковалентним неполярним типом зв'язку можна назвати фтор F 2 , бром Br 2 , йод I 2 азот N 2 .
Якщо атоми, які взаємодіють, мають різну електронегативність (атоми різних хімічних елементів), то загальна електронна пара зміщуватиметься до атома з більшою електронегативністю. У цьому атомі з більшою електронегативністю формується частковий негативний заряд, але в атомі з меншою електронегативністю - частковий позитивний заряд. Ці часткові заряди за абсолютним значенням менше одиниці.
Наприклад, при утворенні молекули водень хлориду HCl відбувається перекриття s-орбіталі атома водню та p-орбіталі атома хлору. Загальна електронна пара розташована несиметрично щодо центрів атомів, що взаємодіють. Вона зміщується більш електронегативного хлору. На атомі хлору формується частковий негативний заряд, але в атомі водню - частковий позитивний заряд. І тут у молекулі центри позитивних і негативних зарядів не збігаються. Такі молекули називають полярними або диполями. Диполь - це система із двох зарядів, які є однаковими за величиною, але протилежними за знаком.
Отже, ковалентний зв'язок, який утворюється між атомами, електронегативності яких відрізняються, але незначно, називають ковалентним полярним зв'язком. Треба запам'ятати, що такий тип хімічного зв'язку утворюється у складних речовинах, утворених атомами неметалів. Як приклади речовин з ковалентною полярним типом зв'язку можна назвати водень фторид HF, вода H 2 O, аміак NH 3 метан CH 4 карбон (IV) оксид CO 2 .
Іонний зв'язок утворюється в результаті повного перенесення одного або кількох електронів від одного атома до іншого. Такий тип зв'язку можливий лише між атомами елементів, електронегативність яких значно відрізняються. При цьому відбувається перехід електрона від атома з меншою від'ємністю до атома з більшою від'ємністю. Треба запам'ятати, що такий тип хімічного зв'язку утворюється між атомами металів та неметалів. Наприклад, елементи першої та другої групи головних підгруп періодичної системи(типові метали) безпосередньо з'єднуються з елементами шостої та сьомої групи головних підгруп періодичної системи (типові неметали).
Розглянемо механізм утворення іонного зв'язку у складі хлорид калій. Атом калію містить один валентний електрон (визначаємо за номером групи, де знаходиться Калій). Атом хлору містить сім валентних електронів (визначаємо за номером групи, де знаходиться Хлор). При взаємодії атомів калію з атомами хлору валентний електрон атома калію повністю переходить на зовнішній рівень атома хлору, добудовуючи його у восьмиелектронній структурі. При цьому атом калію, втрачаючи електрон, набуває позитивного заряду +1 і перетворюється на катіон K + , а атом хлору, приєднуючи електрон, набуває негативного заряду -1 і перетворюється на аніон Cl - . Різноіменно заряджені іони притягуються завдяки електростатичним силам та утворюється з'єднання калій хлорид. Цей процес можна зобразити схемою:
Лише деякі хімічні елементи (благородні гази) за звичайних умов перебувають у стані одноатомного газу. Атоми інших елементів, навпаки, в індивідуальному вигляді не існують, а входять до складу молекул або кристалічних ґрат, утворених сукупністю атомів. Отже, є причина, через яку атоми зв'язуються друг з одним. Цією причиною є хімічний зв'язок, зумовлений тим, що між атомами діють певні електростатичні сили, здатні утримувати один до одного атоми. Доведено, що в утворенні хімічного зв'язку між атомами головна рольналежить валентним електронам (електронам зовнішнього рівня, слабкий пов'язані з ядром).
Згідно з теорією хімічного зв'язку найбільшу міцність мають зовнішні оболонки, що складаються з двох або восьми електронів. Шляхетні гази мають такі електронні оболонки. Це і є причиною того, що благородні гази за звичайних умов не вступають у хімічні реакції з іншими елементами. Атоми, які мають на зовнішньому рівні менше восьми (або двох) електронів, намагаються придбати структури благородних газів. Тому при утворенні молекули в ході хімічної реакції атоми намагаються придбати стійку восьмиелектронну або двоелектронну оболонку.
Утворення стійкої електронної конфігурації може відбуватися деякими способами і призводити до утворення молекул або немолекулярних сполук різної будови. Внаслідок цього розрізняють ковалентні та іонні типи хімічного зв'язку. Крім цих видів, існують інші типи хімічного зв'язку: металевий та водневий (міжмолекулярний).
Формальний заряд атома в сполуках - допоміжна величина, зазвичай її використовують в описах властивостей елементів хімії. Цей умовний електричний заряд є ступінь окислення. Його значення змінюється внаслідок багатьох хімічних процесів. Хоча заряд є формальним, він яскраво характеризує властивості та поведінку атомів в окисно-відновних реакціях (ОВР).
Окислення та відновлення
У минулому хіміки використовували термін окислення, щоб описати взаємодію кисню з іншими елементами. Назва реакцій походить від латинського найменування кисню - Oxygenium. Пізніше з'ясувалося, що інші елементи також окислюють. І тут вони відновлюються — приєднують електрони. Кожен атом під час утворення молекули змінює будову своєї валентної електронної оболонки. І тут з'являється формальний заряд, величина якого залежить кількості умовно відданих чи прийнятих електронів. Для характеристики цієї величини раніше застосовували англійський хімічний термін "oxidation number", який у перекладі означає окислювальне число. При його використанні виходять з припущення, що електрони, що зв'язують, в молекулах або іонах належать атому, що володіє більш високим значеннямелектронегативності (ЕО). Здатність утримувати свої електрони та притягувати їх від інших атомів добре виражена у сильних неметалів (галогенів, кисню). Протилежними властивостями мають сильні метали (натрій, калій, літій, кальцій, інші лужні та лужноземельні елементи).
Визначення ступеня окиснення
Ступенем окислення називають заряд, який атом придбав у тому випадку, якби електрони, що беруть участь в утворенні зв'язку, повністю змістилися до більш електронегативного елементу. Є речовини, що не мають молекулярної будови (галогеніди лужних металів та інші сполуки). У цих випадках ступінь окислення збігається із зарядом іона. Умовний чи реальний заряд показує, який процес стався до того, як атоми набули свого нинішнього стану. Позитивне значення ступеня окислення - це загальна кількість електронів, видалених з атомів. Негативне значенняступеня окислення дорівнює числу набутих електронів. По зміні стану окислення хімічного елемента судять у тому, що відбувається з його атомами під час реакції (і навпаки). За кольором речовини визначають, які зміни в стані окислення. Сполуки хрому, заліза та інших елементів, у яких вони виявляють різну валентність, пофарбовані неоднаково.
Негативне, нульове та позитивне значення ступеня окислення

Прості речовини утворені хімічними елементамиз однаковим значеннямЕО. У цьому випадку зв'язувальні електрони належать всім структурним частинкам рівною мірою. Отже, у простих речовинах елементам невластиво стан окислення (Н 0 2 , О 0 2 , З 0). Коли атоми приймають електрони чи загальна хмара зміщується у тому бік, заряди прийнято писати зі знаком " мінус " . Наприклад, F-1, О-2, С-4. Віддаючи електрони, атоми набувають реального чи формального позитивного заряду. В оксиді OF 2 атом кисню віддає по одному електрону двом атомам фтору і знаходиться в стані окислення +2. Вважають, що в молекулі або багатоатомному іоні електронегативні атоми отримують всі зв'язуючі електрони.
Сірка — елемент, що виявляє різні валентність та ступеня окислення
Хімічні елементи головних підгруп найчастіше виявляють нижчу валентність рівну VIII. Наприклад, валентність сірки у сірковододі та сульфідах металів - II. Для елемента характерні проміжні та вища валентність у збудженому стані, коли атом віддає один, два, чотири або всі шість електронів і виявляє відповідно валентності I, II, IV, VI. Такі ж значення, тільки зі знаком "мінус" або "плюс", мають ступінь окислення сірки:
- у сульфіді фтору віддає один електрон: -1;
- у сірковододі нижче значення: -2;
- у діоксиді проміжний стан: +4;
- у триоксиді, сірчаній кислоті та сульфатах: +6.
У своєму вищому стані окислення сірка тільки приймає електрони, нижчою мірою — виявляє сильні відновлювальні властивості. Атоми S+4 можуть виявляти у з'єднаннях функції відновників або окислювачів залежно від умов.
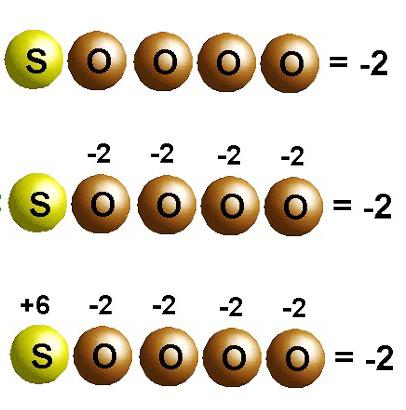
Перехід електронів у хімічних реакціях
При утворенні кристала кухонної солі натрій віддає електрони електронегативнішим хлору. Ступені окислення елементів збігаються із зарядами іонів: Na +1 Cl -1 . Для молекул, створених шляхом усуспільнення та зміщення електронних пар до більш електронегативного атома, застосовні лише уявлення про формальний заряд. Але можна припустити, що це сполуки складаються з іонів. Тоді атоми, притягуючи електрони, набувають умовного негативного заряду, а віддаючи — позитивного. У реакціях вказують, скільки електронів зміщується. Наприклад, у молекулі діоксиду вуглецю С +4 Про - 2 2 вказаний у верхньому правому куті індекс при хімічному символі вуглецю відображає кількість електронів, віддалених з атома. Для кисню у цій речовині характерний стан окиснення -2. Відповідний індекс при хімічному знаку — кількість доданих електронів в атомі.
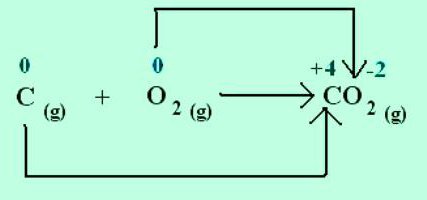
Як підрахувати ступеня окислення
Підрахунок кількості відданих і приєднаних атомами електронів може забрати багато часу. Полегшують це завдання такі правила:
- У простих речовинах ступеня окиснення дорівнюють нулю.
- Сума окислення всіх атомів чи іонів у нейтральній речовині дорівнює нулю.
- У складному іоні сума ступенів окислення всіх елементів має відповідати заряду всієї частки.
- Більше електронегативний атом набуває негативного стану окислення, яке записують зі знаком "мінус".
- Менш електронегативні елементи одержують позитивні ступені окислення, їх записують зі знаком "плюс".
- Кисень в основному виявляє ступінь окислення, що дорівнює -2.
- Для водню характерне значення: +1, у гідридах металів трапляється: Н-1.
- Фтор - найбільш електронегативний із усіх елементів, його стан окислення завжди дорівнює -4.
- Для більшості металів окисні числа та валентності збігаються.

Ступінь окислення та валентність
Більшість сполук утворюються в результаті окисно-відновних процесів. Перехід або зміщення електронів від одних елементів до інших призводить до зміни стану окислення і валентності. Найчастіше ці величини збігаються. Як синонім до терміна «ступінь окислення» можна використовувати словосполучення «електрохімічна валентність». Але є винятки, наприклад, в іоні амонію азот чотиривалентний. Одночасно атом цього елемента перебуває у стані окислення -3. В органічних речовинах вуглець завжди чотиривалентний, але стани окислення атома С в метані СН 4 мурашиному спирті СН 3 ВІН і кислоті НСООН мають інші значення: -4, -2 і +2.
Окисно-відновні реакції

До окисно-відновних відносяться багато найважливіші процесиу промисловості, техніці, живій та неживої природи: горіння, корозія, бродіння, внутрішньоклітинне дихання, фотосинтез та інші явища.
При складанні рівнянь ОВР підбирають коефіцієнти, використовуючи метод електронного балансу, у якому оперують такими категоріями:
- ступеня окиснення;
- відновник віддає електрони та окислюється;
- окислювач приймає електрони та відновлюється;
- число відданих електронів має дорівнювати числу приєднаних.
Придбання електронів атомом призводить до зниження його ступеня окиснення (відновлення). Втрата атомом одного або кількох електронів супроводжується підвищенням окисного числа елемента внаслідок реакцій. Для ОВР, що протікають між іонами сильних електролітів водних розчинахчастіше використовують не електронний баланс, а метод напівреакцій.
Можливо, буде корисно почитати:
- Догадка хороша, а знання краще Прислів'я та приказки про знання;
- Цитати про різнобічну особу;
- До чого сниться Дитина Дівчинка?;
- Сумісність тільця та риб Риби плюс тілець;
- Сумісність знаків зодіаку він тілець вона риби Телець і риби кохання шлюб;
- Літературно-історичні нотатки юного техніка Крижаний похід добровольчої армії;
- Епоха великих реформ у Росії (60-ті роки ХІХ століття);
- Більшовик ногин. Біографія. Григорій Котовський після замаху;