Masa unei litere de substanță. Chimie. Algoritm pentru rezolvarea problemelor folosind ecuații chimice
Spațiul din jurul nostru este plin de diferite corpuri fizice, care constau din diferite substanțe cu mase diferite. Cursurile școlare de chimie și fizică, care introduc conceptul și metoda de găsire a masei unei substanțe, au fost ascultate și uitate în siguranță de toți cei care au studiat la școală. Dar între timp cunoștințe teoretice, achiziționat o singură dată, poate fi necesar în cel mai neașteptat acest moment.
Cu toate acestea, consensul general este că aerul uscat este compus din 21% oxigen, 78% azot și 1% argon. Există o serie de alte gaze prezente în urme, inclusiv dioxid de carbon, hidrogen, heliu, neon, krypton și xenon, dar în scopul acestui exercițiu le vom ignora. Să presupunem că vrem să găsim masa molară a aerului uscat. Mai întâi vom găsi formula masei relative pentru fiecare gaz.
Pentru azot avem. Argonul este un gaz monoatomic, așa că avem. Astfel, masa molară a aerului uscat se calculează după cum urmează. Aflați cantitatea de substanță din probă. Cantitatea de substanță dintr-o probă se calculează împărțind masa probei la masa molară a substanței. De exemplu, să presupunem că avem treizeci de grame de potasiu.
- Măsuri de volume - centimetri cubi, metri. Adică, un butoi de 200 de litri are un volum de 2 m³.
- Măsura densității specifice se găsește folosind tabele și este o valoare constantă pentru fiecare substanță. Densitatea se măsoară în kg/m³, g/cm³, t/m³. Densitatea berii ușoare și altele bauturi alcoolice poate fi vizualizat pe site. Este de 1025,0 kg/m³.
- Din formula densității p=m/V => m=p*V: m = 1025,0 kg/m³* 2 m³=2050 kg.
Un butoi de 200 de litri umplut complet cu bere ușoară va avea o masă de 2050 kg.
Secțiunea i. Chimie generală
Rețineți că pentru o probă de gaz obținem de obicei volumul probei, mai degrabă decât masa. Din fericire, aici vine în ajutor legea lui Avogadro. Această lege prevede că volume egale ale tuturor gazelor la aceeași temperatură și presiune conțin același număr de particule.
Legea lui Avogadro ne spune, de asemenea, că volumul unui mol de orice gaz este de douăzeci și două de puncte - patru litri pe mol la temperatură și presiune standard. Pentru gaze formula noastră va fi. Să presupunem că tocmai am eliberat două sute cincizeci de mililitri de dioxid de carbon la temperatură și presiune standard într-un experiment de laborator. Câți moli din acest gaz avem?
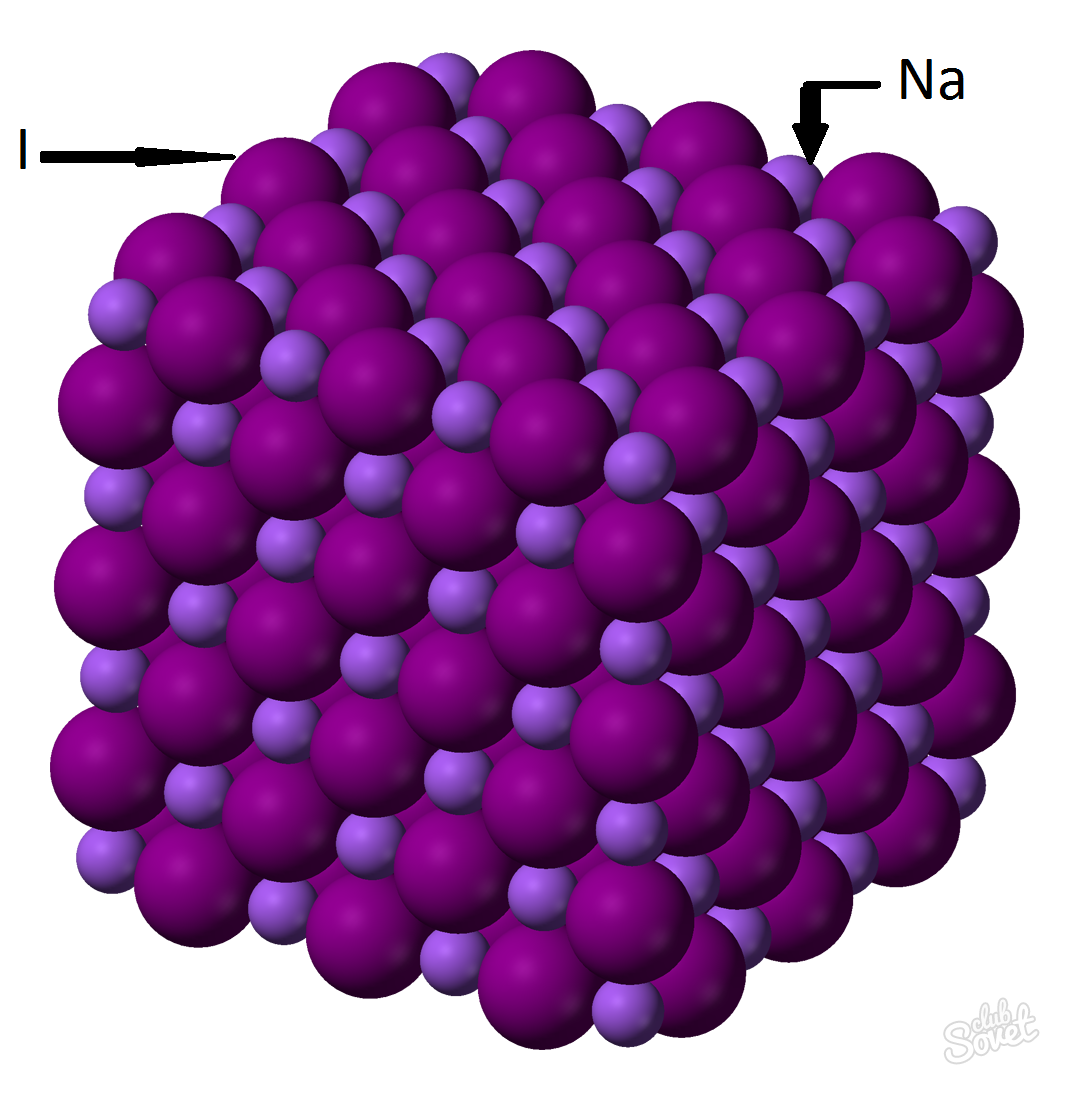
- Masa molară este calculată în sistemul de măsurare SI unificat și se măsoară în kg/mol, g/mol. Masa molară a iodurii de sodiu este suma maselor molare ale fiecărui element: M (NaI) = M (Na) + M (I). Valoarea masei molare a fiecărui element poate fi calculată din tabel sau folosind calculatorul online de pe site: M (NaI)=M (Na)+M (I)=23+127=150 (g/mol) .
- Din formula generală M (NaI)=m (NaI)/v (NaI) => m (NaI)=v (NaI)*M (NaI)= 0,6 mol*150 g/mol=90 grame.
Masa de iodură de sodiu (NaI) cu o fracție de masă de 0,6 mol este de 90 de grame.
Masa probei = Cantitatea de substanță × Masa molară a substanței. Dacă știm numărul de moli ai unei substanțe dintr-o probă, putem calcula masa probei înmulțind cantitatea de substanță cu masa molară a substanței. De exemplu, să presupunem că avem trei moli și jumătate de glucoză.
Volumul probei = Cantitatea de substanță × Volumul molar de substanță. De obicei, aceasta este cel mai probabil să fie o cerință dacă avem de-a face cu o probă de gaz, dar s-ar putea aplica în mod egal la solide sau lichide. Dacă știm numărul de moli ai unei substanțe dintr-o probă, putem calcula volumul probei înmulțind cantitatea de substanță cu volumul molar al substanței. Să presupunem că avem o opteme dintr-un mol de hidrogen.
- Se diluează soluția cu apă. Masa substanței dizolvate X nu se modifică m (X)=m’(X). Masa soluției crește cu masa apei adăugate m’ (p) = m (p) + m (H 2 O).
- Evaporarea apei din soluție. Masa substanței dizolvate X nu se modifică m (X)=m’ (X). Masa soluției scade cu masa apei evaporate m’ (p) = m (p) - m (H 2 O).
- Îmbinând două soluții. Masele soluțiilor, precum și masele substanței dizolvate X, atunci când sunt amestecate, se adună: m’’ (X) = m (X) + m’ (X). m’’ (p)=m (p)+m’ (p).
- Pierderea cristalelor. Masele substanței dizolvate X și ale soluției se reduc cu masa cristalelor precipitate: m' (X) = m (X)-m (precipitat), m' (p) = m (p)-m (precipitat). ).

Aflați numărul de obiecte elementare din probă. Entitățile elementare precum atomii și moleculele sunt în mod evident prea mici pentru a fi numărate, dar ni s-a dat o estimare destul de bună sub forma constantei lui Avogadro a numărului de entități elementare dintr-un mol de materie. Acest lucru ne permite să calculăm numărul de elemente elementare pe care le avem pentru o anumită probă dintr-o substanță, având în vedere că ni se dă fie cantitatea de substanță din probă în moli, masa probei în grame, fie volumul probei. în litri.
Aceasta este formula pentru când ni se dă numărul de moli ai unei substanțe dintr-o probă. Să aflăm câți atomi sunt în trei moli de sodiu. Amintiți-vă că răspunsul va fi număr pur- nicio unitate implicată. Dacă ni se dă masa unei probe în grame, trebuie să împărțim acea masă la masa molară a substanței și apoi să înmulțim rezultatul cu constanta lui Avogadro.

Opțiunile pentru găsirea masei unei substanțe nu sunt un curs școlar util, ci metode care sunt destul de aplicabile în practică. Toată lumea poate găsi cu ușurință masa substanței necesare aplicând formulele de mai sus și folosind tabelele propuse. Pentru a ușura sarcina, notați toate reacțiile și coeficienții acestora.
Să presupunem că vrem să știm numărul de molecule din treizeci și șase de grame de zaharoză. Rețineți că entitatea elementară în acest caz este o moleculă de carbohidrați destul de complexă. De fapt, ați întâlnit deja această substanță - o formă comună de zahăr - în exemplul anterior.
Procedura pentru găsirea numărului de obiecte elementare dintr-o probă de gaz este similară, cu excepția faptului că probabil ni se va da volumul probei în litri. Pentru o probă de gaz, tipul de gaz utilizat nu contează. Important este că ne asigurăm că folosim volumul molar corect.
Decizia cu privire la necesitatea menținerii unui astfel de caiet nu a venit imediat, ci treptat, odată cu acumularea experienței de muncă.
La început, acesta era un spațiu la sfârșitul caietului de lucru - câteva pagini pentru a scrie cele mai importante definiții. Apoi cele mai importante mese au fost amplasate acolo. Apoi a venit conștientizarea că majoritatea elevilor, pentru a învăța să rezolve probleme, au nevoie de instrucțiuni algoritmice stricte, pe care ei, în primul rând, trebuie să le înțeleagă și să le amintească.
Pentru un anumit volum de probă în litri, împărțiți acel volum la volumul molar al substanței, în litri pe mol la o anumită temperatură și presiune, apoi înmulțiți rezultatul cu constanta lui Avogadro. Să presupunem că vrem să aflăm numărul de molecule de dioxid de carbon dintr-o probă de gaz constând din cinci litri de dioxid de carbon. În acest exemplu vom presupune că eșantionul este ținut la temperatura camerei si presiune. în felul următor.
Pentru temperatura și presiunea pentru care volumul molar al unui gaz este necunoscut, acesta poate fi calculat cu ușurință folosind următoarea ecuație standard. O unitate destul de confuză legată de constanta gazului este litru de atmosferă pe mol pe kilovolt. Nu-ți face griji dacă acest lucru nu înseamnă nimic pentru tine în acest moment. Rețineți, totuși, că există mai multe opțiuni diferite constanta de gaz. Utilizarea corectă va depinde de unitățile de presiune, temperatură și volum. Aceasta este adesea o sursă de confuzie pentru elevi - și pentru câțiva profesori!
Atunci s-a luat decizia de a păstra, pe lângă carnetul de muncă, un alt caiet obligatoriu de chimie - un dicționar de chimie. Spre deosebire de caietele de lucru, dintre care pot fi chiar două pe parcursul unui an universitar, un dicționar este un singur caiet pentru întregul curs de chimie. Cel mai bine este ca acest notebook să aibă 48 de coli și o copertă rezistentă.
Ramura științei care studiază caracteristicile și compoziția tuturor materialelor, modificările pe care le pot suferi și legile care guvernează astfel de modificări. Schimbare fizică: atunci când corpul își schimbă forma exterioară, dar compoziția sa internă este aceeași.
Apa de congelare Se toarna pahar Ulei de distilare Max apa si nisip. . Schimbarea chimică: Aceasta este atunci când structura internă a unei substanțe este modificată astfel încât se creează o altă substanță diferită, de obicei din cauza arderii. Colorare cămașă. . Știință: cunoștințe organizate colectate prin metoda științifică.
Aranjam materialul din acest caiet astfel: la inceput - cele mai importante definitii, pe care copiii le copiaza din manual sau le noteaza sub dictarea profesorului. De exemplu, la prima lecție din clasa a VIII-a, aceasta este definiția materiei „chimie”, conceptul de „reacții chimice”. Pe parcursul anului școlar în clasa a VIII-a se acumulează mai mult de treizeci. Efectuez sondaje asupra acestor definiții în unele lecții. De exemplu, o întrebare orală în lanț, când un elev îi pune o întrebare altuia, dacă a răspuns corect, atunci el pune deja următoarea întrebare; sau, când unui elev i se adresează întrebări de către alți studenți, dacă nu poate răspunde, atunci ei își răspund singuri. În chimia organică, acestea sunt în principal definiții ale claselor de substanțe organice și concepte principale, de exemplu, „omologi”, „izomeri” etc.
Compus: Substanțe pure formate din unul sau mai multe elemente combinate în proporții fixe. Difuzia: capacitatea gazelor de a se amesteca cu ușurință între ele. Element: substanțe fundamentale prin care sunt create toate lucrurile materiale.
Energie: capacitatea de a lucra sau de a transfera căldură. Energia potențială: energia stocată pe care o are un organism compoziție chimică sau pozitia ta. Starile de agregare: modul în care găsim corpul. Solid: definește forma și volumul. Moleculele lor sunt aproape una de alta.
La sfârșitul cărții noastre de referință, materialul este prezentat sub formă de tabele și diagrame. Pe ultima pagină se află chiar primul tabel „Elemente chimice. Semne chimice”. Apoi tabelele „Valență”, „Acizi”, „Indicatori”, „Seria electrochimică a tensiunilor metalice”, „Seria de electronegativitate”.
Vreau în special să mă opresc asupra conținutului tabelului „Correspondența acizilor cu oxizii acizi”:
Ia forma unui recipient. Gazos: nu au formă sau volum definit. Perioada antică: Primele mari civilizații au învățat să combine substanțe pentru a face altele, precum sticla și coloranții. S-au uitat la 4 elemente ca bază pentru tot.
Alchimie: Oamenii de știință s-au dedicat combinării substanțelor pentru a crea aur sau elixirul vieții. Iatrochimie: alchimiștii au găsit substanțe complexe cu Proprietăți de vindecare. Flogiston: O teorie în care substanțele conțineau flogiston și când ardeau l-au pierdut.
Chimia modernă: începe cu Antoine Lavoisier, unde se creează legea conservării materiei. Legea conservării materiei: „Materia nu este nici creată, nici distrusă, ci doar transformată”. Legea conservării energiei: „Energia nu este nici creată, nici distrusă, ci transformată.”
| Corespondența acizilor cu oxizii acizi | ||||
| Oxid acid | Acid | |||
| Nume | Formulă | Nume | Formulă | Reziduu acid, valență |
| monoxid de carbon (II). | CO2 | cărbune | H2CO3 | CO3(II) |
| oxid de sulf(IV). | SO 2 | sulfuros | H2SO3 | SO3(II) |
| oxid de sulf(VI). | SO 3 | sulfuric | H2SO4 | SO 4 (II) |
| oxid de siliciu (IV). | SiO2 | siliciu | H2SiO3 | SiO3(II) |
| oxid nitric (V) | N2O5 | azot | HNO3 | NO3 (I) |
| oxid de fosfor (V). | P2O5 | fosfor | H3PO4 | PO 4 (III) |
Fără înțelegerea și memorarea acestui tabel, elevilor de clasa a VIII-a le este greu să compună ecuații pentru reacțiile oxizilor acizi cu alcalii.
Când studiem teoria disociației electrolitice, notăm diagrame și reguli la sfârșitul caietului.
Reguli pentru alcătuirea ecuațiilor ionice:
1. Formulele electroliților puternici solubili în apă sunt scrise sub formă de ioni.
Masă: cantitatea de materie conținută într-un corp. Subiect: Aceasta este ceea ce se face în Univers. Metodă științifică: ordine de conduită cercetare științifică. Definiți și formulați problema. Colectați date despre problemă. Analizați datele și propuneți posibile soluții.
Faceți un plan sau efectuați experimente. Evaluați rezultatele. Amestec: o compoziție de două sau mai multe substanțe în compoziție variabilă. Amestecul eterogen: nu conține proprietăți omogene, componentele sale pot fi distinse cu ochiul liber. Amestec omogen: compoziție omogenă a unei combinații de substanțe.
2. Formulele substanțelor simple, oxizilor, electroliților slabi și tuturor substanțelor insolubile sunt scrise în formă moleculară.
3. Formulele substanțelor slab solubile din partea stângă a ecuației sunt scrise în formă ionică, în dreapta - în formă moleculară.
Când studiem chimia organică, scriem în dicționar tabele generale despre hidrocarburi, clase de substanțe care conțin oxigen și azot și diagrame despre conexiunile genetice.
Miscibilitate: proprietăți ale lichidelor amestecate uniform. Greutate: Aceasta este atracția gravitațională a unui corp către altul. Organic: studiul substanțelor care conțin carbon. Substante anorganice: studiaza substantele care nu contin carbon. Analitic: Studiază compoziția unei substanțe.
Biochimie: cercetare reacții chimice organisme vii. Soluție: Acesta este un amestec omogen, are o compoziție omogenă și aspect. Substanță pură: o substanță chimică individuală compusă în întregime dintr-o singură clasă de materie. Vâscozitate: rezistența fluidului de a curge ușor.
| Mărimi fizice | |||
| Desemnare | Nume | Unități | Formule |
| cantitate de substanță | cârtiță | = N / N A ; = m/M; V / V m (pentru gaze) |
|
| N / A | constanta lui Avogadro | molecule, atomi și alte particule | NA = 6,02 10 23 |
| N | numărul de particule | molecule, atomi și alte particule |
N = N A |
| M | Masă molară | g/mol, kg/kmol | M = m/; /M/ = M r |
| m | greutate | g, kg | m = M; m = V |
| Vm | volumul molar de gaz | l/mol, m3/kmol | Vm = 22,4 l / mol = 22,4 m 3 / kmol |
| V | volum | l, m 3 | V = V m (pentru gaze); |
| densitate | g/ml; | =m/V; M / V m (pentru gaze) Proton: o particulă subatomică care are o sarcină pozitivă și face parte din nucleul unui atom. Neutron: o particulă neutră din punct de vedere electric găsită în nucleu lângă proton. Electron: o particulă încărcată negativ care ocupă spațiul din jurul unui atom. Masa sau greutatea atomică: masa medie ponderată a atomilor unui atom. Aceasta este suma protonilor plus electronii. Este reprezentat de litera A. Număr atomic: Numărul de protoni pe care îi are un atom. Izotop: Atomi ai unui anumit element care au un număr diferit de neutroni. Anioni: un ion cu sarcină negativă. |
|
Peste 25 - perioada de vara Predat chimie la școală, a trebuit să lucrez folosind diferite programe și manuale. În același timp, a fost întotdeauna surprinzător că practic niciun manual nu învață cum să rezolvi problemele. La începutul studiului chimiei, pentru a sistematiza și consolida cunoștințele în dicționar, eu și studenții mei alcătuim un tabel „Mărimi fizice” cu mărimi noi:
Cationi: ioni încărcați pozitiv. Toate elementele sunt formate din particule minuscule, indivizibile, numite „atomi”, care nu pot fi distruse. Toți atomii unui element sunt la fel. Toți atomii de elemente amestecați în proporții fixe formează compuși.
O reacție chimică implică modificări. Legea compoziției constante. Un compus conține întotdeauna elemente în anumite proporții definite și în nicio altă combinație. Se mai numește și legea proporțiilor determinate. A fost proclamat de Joseph Proust.
Dacă două elemente formează mai mult de un compus, diferitele mase ale elementelor care se combină în masa fixă a celui de-al doilea element au o fracție de număr întreg. Greutate moleculară: suma mase atomice fiecare atom care alcătuiește o moleculă. Numărul lui Avogadro: numărul de particule pe mol.
Când îi înveți pe elevi cum să rezolve probleme de calcul, este foarte mare importanță O dau la algoritmi. Consider că instrucțiunile stricte pentru succesiunea acțiunilor permit unui elev slab să înțeleagă soluția unor probleme de un anumit tip. Pentru studenții puternici, aceasta este o oportunitate de a atinge un nivel creativ în educația chimică și autoeducația ulterioară, deoarece mai întâi trebuie să stăpâniți cu încredere un număr relativ mic de tehnici standard. Pe baza acestui fapt, se va dezvolta capacitatea de a le aplica corect în diferite etape ale rezolvării unor probleme mai complexe. Prin urmare, am compilat algoritmi pentru rezolvarea problemelor de calcul pentru toate tipurile de probleme ale cursurilor școlare și pentru clasele opționale.
Mol: un mol este egal cu suma maselor atomice ale fiecărui atom care formează molecula compusului. Acest număr va fi egal cu un mol din acest compus. În primul rând, se respectă regula proporției. În primul rând, se calculează greutatea moleculară. Electronii atomilor se găsesc în niveluri de energie, sau straturi, care cresc în energie pe măsură ce distanța față de nucleul atomic crește. Prin urmare, cu cât electronul este mai aproape de centrul atomului, cu atât energia acestuia este mai mică. Aceste numere cuantice sunt notate cu numere întregi sau litere.
Numărul cuantic fundamental determină energia orbitei. Electronii care umplu ultimul nivel de energie al unui atom sunt cunoscuți ca electroni de valență. Numărul maxim de electroni în care poate fi admis ultimul nivel, este de opt electroni, cu excepția atomilor de hidrogen și heliu, care au un număr maxim de electroni de valență.
Voi da exemple pentru unele dintre ele.
Algoritm pentru rezolvarea problemelor folosind ecuații chimice.
1. Scrieți pe scurt condițiile problemei și compuneți o ecuație chimică.
2. Scrieți datele problemei deasupra formulelor din ecuația chimică și scrieți numărul de moli sub formule (determinat de coeficient).
3. Aflați cantitatea de substanță a cărei masă sau volum este dată în enunțul problemei, folosind formulele:
M/M; = V / V m (pentru gaze V m = 22,4 l / mol).
Scrieți numărul rezultat deasupra formulei din ecuație.
4. Aflați cantitatea unei substanțe a cărei masă sau volum este necunoscută. Pentru a face acest lucru, raționați conform ecuației: comparați numărul de moli în funcție de condiție cu numărul de moli conform ecuației. Dacă este necesar, faceți o proporție.
5. Aflați masa sau volumul folosind formulele: m = M; V = Vm.
Acest algoritm este baza pe care elevul trebuie să o stăpânească pentru ca în viitor să poată rezolva probleme folosind ecuații cu diverse complicații.
Probleme cu excesul și deficiența.
Dacă în condițiile problemei cantitățile, masele sau volumele a două substanțe care reacţionează sunt cunoscute deodată, atunci aceasta este o problemă cu exces și deficiență.
La rezolvare:
1. Trebuie să găsiți cantitățile a două substanțe care reacţionează folosind formulele:
M/M; = V/V m .
2. Scrieți numerele mol rezultate deasupra ecuației. Comparându-le cu numărul de moli conform ecuației, trageți o concluzie despre care substanță este dată în deficiență.
3. Pe baza deficienței, faceți calcule suplimentare.
Probleme cu privire la fracția din randamentul produsului de reacție obținut practic din teoretic posibil.
Cu ajutorul ecuațiilor de reacție se efectuează calcule teoretice și se găsesc date teoretice pentru produsul de reacție: teor. , m teor. sau teoria V. . La efectuarea reacțiilor în laborator sau în industrie apar pierderi, deci datele practice obținute sunt practice. ,
m practică. sau V practice. întotdeauna mai puțin decât datele calculate teoretic. Cota de randament este desemnată prin litera (eta) și se calculează folosind formulele:
(acest) = practic. / teorie = m practic. / m teor. = V practic / V teor.
Se exprimă ca fracție de unitate sau ca procent. Se pot distinge trei tipuri de sarcini:
Dacă în enunțul problemei sunt cunoscute datele pentru substanța inițială și fracțiunea din randamentul produsului de reacție, atunci trebuie să găsiți o soluție practică. , m practic sau V practice. produs de reacție.
Procedura de rezolvare:
1. Efectuați un calcul folosind ecuația bazată pe datele pentru substanța inițială, găsiți teoria. , m teor. sau teoria V. produs de reacție;
2. Aflați masa sau volumul produsului de reacție obținut practic folosind formulele:
m practică. = m teoretic ; V practic = V teor. ; practic = teoretic .
Dacă în enunțul problemei sunt cunoscute datele pentru substanța inițială și practica. , m practic sau V practice. produsul rezultat și trebuie să găsiți fracția de randament a produsului de reacție.
Procedura de rezolvare:
1. Calculați folosind ecuația pe baza datelor pentru substanța inițială, găsiți
Theor. , m teor. sau teoria V. produs de reacție.
2. Aflați fracția de randament a produsului de reacție folosind formulele:
Practică. / teorie = m practic. / m teor. = V practic /V teor.
Dacă condiţiile practice sunt cunoscute în condiţiile problemei. , m practic sau V practice. produsul de reacție rezultat și fracția sa de randament, în timp ce trebuie să găsiți date pentru substanța inițială.
Procedura de rezolvare:
1. Găsiți teorie, m teorie. sau teoria V. produs de reacție după formulele:
Theor. = practic / ; m teor. = m practic. / ; V teor. = V practic / .
2. Efectuați calcule folosind ecuația bazată pe teorie. , m teor. sau teoria V. produsul reacției și găsiți datele pentru substanța inițială.
Desigur, luăm în considerare aceste trei tipuri de probleme treptat, exersând abilitățile de rezolvare a fiecăreia dintre ele folosind exemplul unui număr de probleme.
Probleme la amestecuri și impurități.
O substanta pura este cea care este mai abundenta in amestec, restul sunt impuritati. Denumiri: masa amestecului – m cm, masa substanței pure – m p.h., masa impurităților – m aprox. , fracția de masă a substanței pure - p.h.
Fracția de masă a unei substanțe pure se găsește folosind formula: p.h. = m h.v. / m cm, se exprimă în fracțiuni de unu sau ca procent. Să distingem 2 tipuri de sarcini.
Dacă formularea problemei oferă fracția de masă a unei substanțe pure sau fracția de masă a impurităților, atunci masa amestecului este dată. Cuvântul „tehnic” înseamnă și prezența unui amestec.
Procedura de rezolvare:
1. Aflați masa unei substanțe pure folosind formula: m h.v. = h.v. m cm
Dacă este dată fracția de masă a impurităților, atunci trebuie mai întâi să găsiți fracția de masă a substanței pure: p.h. = 1 - aprox.
2. Pe baza masei substanței pure, efectuați calcule suplimentare folosind ecuația.
Dacă formularea problemei oferă masa amestecului inițial și n, m sau V a produsului de reacție, atunci trebuie să găsiți fracția de masă a substanței pure din amestecul inițial sau fracția de masă a impurităților din acesta.
Procedura de rezolvare:
1. Calculați folosind ecuația pe baza datelor pentru produsul de reacție și găsiți n p.v. și m h.v.
2. Aflați fracția de masă a substanței pure din amestec folosind formula: p.h. = m h.v. / m vezi și fracția de masă a impurităților: aprox. = 1 - h.v
Legea relațiilor volumetrice ale gazelor.
Volumele de gaze sunt legate în același mod ca și cantitățile lor de substanțe:
V 1 / V 2 = 1 / 2
Această lege este folosită atunci când rezolvați probleme folosind ecuații în care este dat volumul unui gaz și trebuie să găsiți volumul altui gaz.
Fracția volumică a gazului din amestec.
Vg / Vcm, unde (phi) este fracția de volum a gazului.
Vg – volumul de gaz, Vcm – volumul amestecului de gaze.
Dacă enunțul problemei oferă fracția de volum a gazului și volumul amestecului, atunci, în primul rând, trebuie să găsiți volumul gazului: Vg = Vcm.
Volumul amestecului de gaze se află folosind formula: Vcm = Vg /.
Volumul de aer consumat la arderea unei substanțe se află prin volumul de oxigen găsit prin ecuația:
Vair = V(02)/0,21
Derivarea formulelor de substanțe organice folosind formule generale.
Substanțele organice formează serii omoloage care au formule comune. Asta permite:
1. Exprimați greutatea moleculară relativă în termeni de număr n.
M r (C n H 2n + 2) = 12 n + 1 (2n + 2) = 14n + 2.
2. Echivalați M r, exprimat prin n, cu adevăratul M r și găsiți n.
3. Întocmește ecuații de reacție în vedere generalași efectuați calcule pe ele.
Derivarea formulelor de substanțe pe bază de produse de ardere.
1. Analizați compoziția produselor de ardere și trageți o concluzie despre compoziția calitativă a substanței arse: H 2 O -> H, CO 2 -> C, SO 2 -> S, P 2 O 5 -> P, Na 2 CO3 -> Na, C.
Prezența oxigenului în substanță necesită verificare. Notați indicii din formulă cu x, y, z. De exemplu, CxHyOz (?).
2. Aflați cantitatea de substanțe din produsele de ardere folosind formulele:
n = m / M și n = V / Vm.
3. Aflați cantitățile de elemente conținute în substanța arsă. De exemplu:
Convertiți numerele în numere întregi împărțindu-le la cel mai mic.
Scrieți formula adevărată.
Derivarea formulelor de substanțe pe baza fracțiilor de masă ale elementelor.
1. Scrieți o formulă, notând indicii cu x, y, z.
2. Găsiți raportul indicilor pentru a face acest lucru, împărțiți fracția de masă a fiecărui element la masa sa atomică: x: y: z = 1 / Ar 1: 2 / Ar 2: 3 / Ar 3.
3. Reduceți numerele rezultate la numere întregi împărțindu-le la cel mai mic dintre ele. Dacă este necesar, după împărțire, înmulțiți cu 2, 3, 4, 5.
Această metodă de soluție determină cea mai simplă formulă. Pentru majoritatea substantelor anorganice coincide cu cea adevarata, pentru substantele organice este invers.
Derivarea formulelor de substanțe pe baza fracțiilor de masă ale elementelor, dacă sunt cunoscute datele pentru aflarea masei molare a substanței.
Aflați masa molară a substanței folosind formulele:
a) dacă densitatea gazului este cunoscută: M = Vm = g / l 22,4 l / mol; r = m/V.
b) dacă densitatea relativă este cunoscută: M 1 = D 2 M 2, M = D H2 2, M = D O2 32,
M = D aer 29, M = D N2 28 etc.
Metoda 1: găsiți cea mai simplă formulă a substanței (vezi algoritmul anterior) și cea mai simplă masă molară. Apoi comparați masa molară adevărată cu cea mai simplă și creșteți indicii din formulă de numărul necesar de ori.
Metoda 2: găsiți indicii folosind formula n = (e) Mr / Ar(e).
Dacă fracția de masă a unuia dintre elemente este necunoscută, atunci trebuie găsită. Pentru a face acest lucru, scădeți fracția de masă a celuilalt element din 100% sau din unitate.
Treptat, în cursul studierii chimiei, algoritmii de rezolvare a problemelor se acumulează în dicționarul chimic tipuri diferite. Iar studentul știe întotdeauna unde să găsească formula potrivită sau informațiile necesare pentru a rezolva o problemă.
Mulți studenți le place să păstreze un astfel de caiet, ei înșiși îl completează cu diverse materiale de referință.
În ceea ce privește activitățile extracurriculare, elevii mei și cu mine avem și un caiet separat pentru notarea algoritmilor de rezolvare a problemelor care depășesc curiculumul scolar. În același caiet, pentru fiecare tip de problemă notăm 1-2 exemple ele rezolvă restul problemelor în alt caiet. Și, dacă vă gândiți bine, dintre miile de probleme diferite care apar la examenul de chimie din toate universitățile, puteți identifica 25 - 30 de tipuri diferite de probleme. Desigur, există multe variații între ele.
În dezvoltarea algoritmilor pentru rezolvarea problemelor la cursurile opționale, manualul A.A. m-a ajutat foarte mult. Kushnareva. (Învățarea rezolvării problemelor din chimie, - M., Școala - presă, 1996).
Capacitatea de a rezolva probleme de chimie este principalul criteriu pentru stăpânirea creativă a materiei. Prin rezolvarea unor probleme de diferite niveluri de complexitate, un curs de chimie poate fi stăpânit eficient.
Dacă un student are o înțelegere clară a tuturor tipurilor posibile de probleme și a rezolvat un număr mare de probleme de fiecare tip, atunci va putea face față examenului de chimie sub forma Examenului de stat unificat și la intrarea în universități.
Ar putea fi util să citiți:
- Ghicitor pe zaț de cafea, adică cocoș;
- Mitralierele rusești Kalashnikov - dezvoltator de frunte postbelic al URSS;
- Genele ADN mitocondrial;
- Compatibilitatea Pești și Pești: dragoste altruistă sau relații instabile Compatibilitatea conform horoscopului Peștilor este ca;
- Cum să returnezi un bărbat iubit fără comunicare - conspirații dovedite ale vrăjitorilor puternici Cum să returnezi o persoană la tine;
- Scolecifobia și cum să o combatem;
- Experții sunt în favoarea extinderii operațiunii ISS;
- Structura și activitatea vitală a ciliatelor folosind exemplul ciliatului papuc;