En düşük oksidasyon durumu nasıl hesaplanır. Oksidasyon derecesi nedir? Elementlerin oksidasyon durumu nasıl belirlenir?
böyle bir öğe Okul müfredatı Kimya, çoğu modern okul çocuğu için sayısız zorluğa neden olduğundan, çok azı bileşiklerdeki oksidasyon derecesini belirleyebilir. En büyük zorluklar, inorganik kimya okuyan okul çocukları, yani temel okul öğrencileri (8-9. Sınıflar) içindir. Konunun yanlış anlaşılması, öğrenciler arasında bu konuya düşmanlığın ortaya çıkmasına neden olur.
Öğretmenler, ortaokul ve lise öğrencilerinin kimyadan bu kadar "sevilmemelerinin" bir dizi nedenini belirler: karmaşık kimyasal terimleri anlama isteksizliği, belirli bir süreci dikkate almak için algoritmaları kullanamama, matematiksel bilgiyle ilgili sorunlar. Rusya Federasyonu Milli Eğitim Bakanlığı konunun içeriğinde ciddi değişiklikler yaptı. Ek olarak, kimya öğretimi için saat sayısı "kısaltıldı". Bunun, konudaki bilgi kalitesi üzerinde olumsuz bir etkisi oldu, disiplin çalışmasına olan ilgide bir azalma oldu.
Kimya dersinin hangi konuları okul çocukları için en zor olanlardır?
İle yeni program temel okulun akademik disiplini "Kimya" dersi birkaç ciddi konuyu içerir: D. I. Mendeleev'in periyodik element tablosu, inorganik madde sınıfları, iyon değişimi. Sekizinci sınıflar için en zor şey oksitlerin tanımıdır.
yerleştirme kuralları
Her şeyden önce öğrenciler, oksitlerin oksijen içeren karmaşık iki elementli bileşikler olduğunu bilmelidir. Önkoşul ikili bir bileşiğin oksitler sınıfına ait olması, bu bileşikteki oksijenin ikinci konumudur.
Asit Oksitler için Algoritma
Başlamak için, oksidasyon durumlarının elementlerin değerliliğinin sayısal ifadeleri olduğunu not ediyoruz. metal olmayanlar veya dört ila yedi değerlikli metaller tarafından oluşturulur, bu tür oksitlerde ikincisi mutlaka oksijendir.
Oksitlerde, oksijenin değerliği her zaman ikiye karşılık gelir, D. I. Mendeleev'in periyodik element tablosundan belirlenebilir. Periyodik tablonun ana alt grubunun 6. grubunda yer alan oksijen gibi tipik bir metal olmayan, dış enerji seviyesini tamamen tamamlamak için iki elektron alır. Oksijen içeren bileşiklerdeki metal olmayanlar, çoğunlukla grubun sayısına karşılık gelen daha yüksek bir değer sergiler. Kimyasal elementlerin oksidasyon durumunun pozitif (negatif) bir sayıyı ifade eden bir gösterge olduğunu hatırlamak önemlidir.
Formülün başındaki metal olmayan, pozitif bir oksidasyon durumuna sahiptir. Metal olmayan oksijen oksitlerde kararlıdır, indeksi -2'dir. Asit oksitlerdeki değerlerin düzenlenmesinin güvenilirliğini kontrol etmek için, belirlediğiniz tüm sayıları belirli bir elementin indeksleriyle çarpmanız gerekecektir. Ayarlanan derecelerin tüm artılarının ve eksilerinin toplamı 0 ise hesaplamalar güvenilir kabul edilir.

İki elemanlı formüllerin derlenmesi
Elementlerin atomlarının oksidasyon durumu, iki elementten bileşikler oluşturma ve kaydetme şansı verir. Formül oluştururken yeni başlayanlar için her iki simge yan yana yazılır, oksijeni ikinci sıraya koyduğunuzdan emin olun. Kaydedilen işaretlerin her birinin üzerinde, oksidasyon durumlarının değerleri belirtilir, ardından bulunan sayılar arasında, her iki basamağa da kalan olmadan bölünecek sayı bulunur. Bu gösterge, iki elementli maddenin birinci ve ikinci bileşenleri için indeksler elde ederek oksidasyon derecesinin sayısal değerine ayrı ayrı bölünmelidir. En yüksek oksidasyon durumu, metal olmayanın PS'de durduğu grup numarasıyla aynı olan, tipik bir metal olmayanın en yüksek değerlik değerine sayısal olarak eşittir.
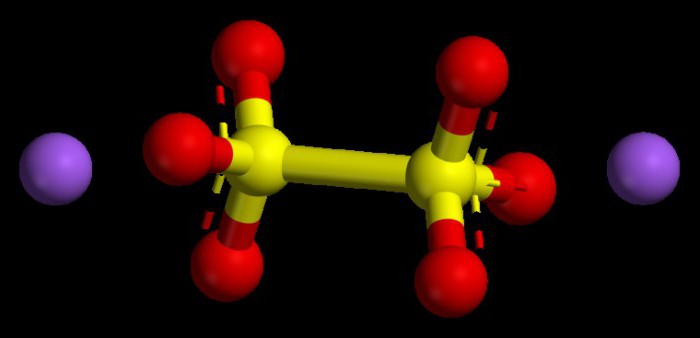
Bazik oksitlerde sayısal değerleri ayarlamak için algoritma
Tipik metallerin oksitleri bu tür bileşikler olarak kabul edilir. Tüm bileşiklerde, +1 veya +2'den fazla olmayan bir oksidasyon durumu indeksine sahiptirler. Bir metalin oksidasyon durumunun ne olacağını anlamak için periyodik tabloyu kullanabilirsiniz. Birinci grubun ana alt gruplarının metalleri için bu parametre her zaman sabittir, grup numarasına yani +1'e benzer.
İkinci grubun ana alt grubunun metalleri de sayısal olarak +2 olan kararlı bir oksidasyon durumu ile karakterize edilir. İndeksleri (sayıları) hesaba katılarak oksitlerin oksidasyon durumları, kimyasal molekülün nötr, yüksüz bir parçacık olduğu düşünüldüğünden, toplamı sıfır olmalıdır.
Oksijen içeren asitlerde oksidasyon durumlarının düzenlenmesi
Asitler, bir tür asit kalıntısı ile ilişkili bir veya daha fazla hidrojen atomundan oluşan karmaşık maddelerdir. Oksidasyon durumlarının sayı olduğu göz önüne alındığında, bunları hesaplamak için bazı matematik becerileri gerekir. Asitlerdeki hidrojen (proton) için böyle bir gösterge her zaman kararlıdır, +1'dir. Ardından, negatif oksijen iyonu için oksidasyon durumunu belirtebilirsiniz, aynı zamanda kararlıdır, -2.
Ancak bu işlemlerden sonra formülün merkezi bileşeninin oksidasyon derecesini hesaplamak mümkündür. Spesifik bir numune olarak, sülfürik asit H2SO4'teki elementlerin oksidasyon durumunun belirlenmesini düşünün. Bu kompleks maddenin molekülünün iki hidrojen protonu, 4 oksijen atomu içerdiğine göre +2+X-8=0 şeklinde bir ifade elde ederiz. Toplamın sıfır oluşturması için kükürt +6 oksidasyon durumuna sahip olacaktır.
Tuzlarda oksidasyon durumlarının düzenlenmesi
Tuzlar, metal iyonları ve bir veya daha fazla asit kalıntısından oluşan karmaşık bileşiklerdir. Her birinin oksidasyon durumlarını belirleme yöntemi oluşturan parçalar kompleks bir tuzda, oksijen içeren asitlerdeki ile aynıdır. Elementlerin oksidasyon durumunun sayısal bir gösterge olduğu göz önüne alındığında, metalin oksidasyon durumunu doğru bir şekilde belirtmek önemlidir.
Tuz oluşturan metal ana alt grupta yer alıyorsa, oksidasyon durumu kararlı olacaktır, grup numarasına karşılık gelir, pozitif bir değerdir. Tuz, benzer bir PS alt grubundan bir metal içeriyorsa, asit kalıntısı ile farklı metalleri göstermek mümkündür. Metalin oksidasyon durumu ayarlandıktan sonra (-2) koyun, ardından merkezi elementin oksidasyon durumu kimyasal denklem kullanılarak hesaplanır.
Örnek olarak, (orta tuz) içindeki elementlerin oksidasyon durumlarının belirlenmesini düşünün. NaNO3. Tuz, grup 1'in ana alt grubunun bir metalinden oluşur, bu nedenle sodyumun oksidasyon durumu +1 olacaktır. Nitratlardaki oksijenin oksidasyon durumu -2'dir. Oksidasyon derecesinin sayısal değerini belirlemek için +1+X-6=0 denklemi kullanılır. Bu denklemi çözerek, X'in +5 olması gerektiğini elde ederiz, bu

GEN'deki temel terimler
Oksidatif ve indirgeme işlemi için öğrencilerin öğrenmesi gereken özel terimler vardır.
Bir atomun oksidasyon durumu, bazı iyonlardan veya atomlardan kendisine doğrudan bağlanma (diğerlerine bağışlama) elektronları yeteneğidir.
Nötr atomlar veya yüklü iyonlar oksitleyici bir madde olarak kabul edilir. Kimyasal reaksiyon elektronları kabul etmek.
İndirgeyici madde, kimyasal etkileşim sürecinde kendi elektronlarını kaybeden yüksüz atomlar veya yüklü iyonlar olacaktır.
Oksidasyon, elektron bağışı için bir prosedür olarak sunulur.
İndirgeme, yüksüz bir atom veya iyon tarafından ek elektronların kabulü ile ilişkilidir.
Redoks işlemi, bir atomun oksidasyon durumunun zorunlu olarak değiştiği bir reaksiyon ile karakterize edilir. Bu tanım, reaksiyonun OVR olup olmadığını nasıl belirleyebileceğinizi anlamanızı sağlar.

GEN Ayrıştırma Kuralları
Bu algoritmayı kullanarak, herhangi bir kimyasal reaksiyondaki katsayıları düzenleyebilirsiniz.
Son adım, söz konusu reaksiyondaki stereokimyasal katsayıların düzenlenmesi olacaktır.
GEN örneği
Öncelikle her bir kimyasal maddedeki oksidasyon durumlarını düzenlemeniz gerekir. Negatif parçacıkların dönüşü (bağlanması) olmadığından, oksidasyon durumunun sıfır olduğuna dikkat edin. İkili ve üç elementli maddelerde oksidasyon durumlarının düzenlenmesine ilişkin kurallar yukarıda tarafımızdan tartışılmıştır.
O zaman, dönüşüm sırasında oksidasyon durumlarının değiştiği atomları veya iyonları belirlemeniz gerekir.
Yazılı denklemin sol tarafında, oksidasyon durumlarını değiştiren atomlar veya yüklü iyonlar izole edilir. Bu bilanço için gereklidir. Öğelerin üzerinde değerleri belirtilmelidir.
Ayrıca, reaksiyon sırasında oluşan atomlar veya iyonlar kaydedilir, + işaretiyle belirtilir, atom tarafından kabul edilen elektronların sayısı - verilen negatif parçacıkların sayısı. Etkileşim sürecinden sonra oksidasyon durumları azalırsa. Bu, elektronların atom (iyon) tarafından kabul edildiği anlamına gelir. Oksidasyon derecesinin artmasıyla, bir atom (iyon) reaksiyon sırasında elektronlar verir.
En az toplam sayısıönce alınan elektronlara, ardından süreçte verilen elektronlara bölünür, katsayılar elde edilir. Bulunan rakamlar istenen stereokimyasal katsayılar olacaktır.
Oksitleyici ajanı, indirgeyici ajanı, reaksiyon sırasında meydana gelen süreçleri belirleyin.
Belirli bir kimyasal reaksiyon için bu algoritmanın pratik uygulamasını düşünün.
Fe+CuSO4=Cu+FeSO4
Tüm basit ve karmaşık maddeler için göstergeleri hesaplıyoruz.
Fe ve Cu basit maddeler olduğu için yükseltgenme durumları 0'dır. CuSO4'te sonra Cu + 2, oksijende -2 ve kükürtte +6 vardır. FeSO4'te: Fe +2, dolayısıyla S +6 hesaplamalarına göre O-2 için.
Şimdi göstergeleri değiştirebilecek elementler arıyoruz, bizim durumumuzda bunlar Fe ve Cu olacak.
Reaksiyondan sonra demir atomunun değeri +2 olduğu için reaksiyonda 2 elektron verilmiş olur. Bakır göstergelerini +2'den 0'a değiştirmiştir, bu nedenle bakır 2 elektron almıştır. Şimdi demir atomu ve iki değerlikli bakır katyonu tarafından alınan ve verilen elektronların sayısını belirliyoruz. Dönüşüm sırasında, iki değerlikli bakır katyonu tarafından iki elektron alınmış ve demir atomu tarafından aynı sayıda elektron verilmiştir.
Bu süreçte, dönüşüm sırasında eşit sayıda elektron alınıp verildiğinden, minimum ortak katını belirlemenin bir anlamı yoktur. Stereokimyasal katsayılar da birliğe karşılık gelecektir. Reaksiyonda demir oksitlenirken indirgeyici maddenin özelliklerini gösterecektir. İki değerlikli bakır katyonu, sahip olduğu reaksiyonda saf bakıra indirgenir. en yüksek derece oksidasyon.

Süreçlerin uygulanması
Oksidasyon hal formülleri 8-9. sınıflarda her öğrenci tarafından bilinmelidir, çünkü bu konu kitaplarımızda yer almaktadır. OGE atamaları. Oksidatif, indirgeyici işaretlerle devam eden herhangi bir işlem önem Hayatımızda. Onlar olmadan insan vücudundaki metabolik süreçler imkansızdır.
Bölüm I
1. Oksidasyon durumu (s. o.) basit iyonlardan oluştuğu varsayımına dayanarak hesaplanan, karmaşık bir maddedeki bir kimyasal elementin atomlarının koşullu yükü.
Bilmelisin!
1) İle bağlantılı olarak. Ö. hidrojen = +1, hidritler hariç.
2) İle bileşiklerde. Ö. oksijen = -2, peroksitler hariç ![]() ve florürler
ve florürler
3) Metallerin oksidasyon durumu her zaman pozitiftir.
İlk üç grubun ana alt gruplarının metalleri için İle. Ö. devamlı:
Grup IA metalleri - s. Ö. = +1,
Grup IIA metalleri - s. Ö. = +2,
Grup IIIA metalleri - s. Ö. = +3.
4) Serbest atomlar ve basit maddeler için s. Ö. = 0.
5) Toplam sn. Ö. bileşikteki tüm elementler = 0.
2. İsim oluşturma yöntemi iki elementli (ikili) bileşikler.

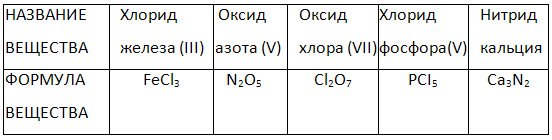
4. "İkili bileşiklerin adları ve formülleri" tablosunu doldurun.
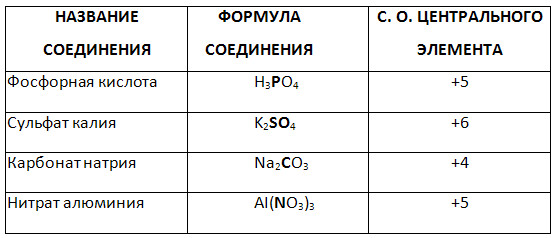
5. Karmaşık bileşiğin vurgulanan elementinin oksidasyon derecesini belirleyin.
Bölüm II
1. Bileşiklerdeki kimyasal elementlerin oksidasyon durumlarını formüllerine göre belirler. Bu maddelerin isimlerini yazınız.

2. Ayrı maddeler FeO, Fe2O3, CaCl2, AlBr3, CuO, K2O, BaCl2, SO3iki gruba ayrılır. Oksidasyon derecesini gösteren maddelerin isimlerini yazınız.

3. Bir kimyasal element atomunun adı ve oksidasyon durumu ile bileşiğin formülü arasında bir yazışma kurun.

4. Maddelerin formüllerini isme göre yapın.

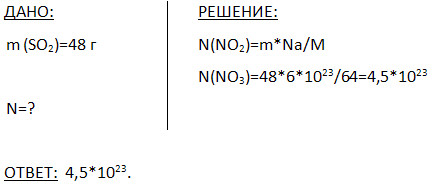
5. 48 g sülfür oksitte (IV) kaç molekül bulunur?
6. İnterneti ve diğer bilgi kaynaklarını kullanarak, aşağıdaki plana göre herhangi bir ikili bağlantının kullanımına ilişkin bir rapor hazırlayın:
1) formül;
2) isim;
3) özellikler;
4) uygulama.
H2O su, hidrojen oksit.
su de normal koşullar sıvı, renksiz, kokusuz, kalın bir tabaka halinde - mavi. Kaynama noktası yaklaşık 100⁰С'dir. İyi bir çözücüdür. Bir su molekülü iki hidrojen atomu ve bir oksijen atomundan oluşur, bu onun kalitatif ve kantitatif bileşimidir. Bu karmaşık bir maddedir, aşağıdakilerle karakterize edilir: Kimyasal özellikler: alkali metaller, toprak alkali metaller ile etkileşim. Su ile değişim reaksiyonlarına hidroliz denir. Bu reaksiyonlar, büyük önem kimyada.
7. K2MnO4 bileşiğindeki manganezin oksidasyon durumu:
3) +6
8. Krom, formülü aşağıdaki olan bir bileşikte en düşük oksidasyon durumuna sahiptir:
1) Cr2O3
9. Klor, formülü aşağıdaki olan bir bileşikte maksimum oksidasyon durumunu sergiler:
3) CI2O7
Oksidasyon derecesi nasıl belirlenir? Periyodik tablo, herhangi bir kimyasal element için belirli bir nicel değeri kaydetmenizi sağlar.
Tanım
İlk olarak, bu terimin ne olduğunu anlamaya çalışalım. Periyodik tabloya göre oksidasyon durumu, kimyasal etkileşim sürecinde bir element tarafından kabul edilen veya verilen elektronların sayısıdır. Hem negatif hem de pozitif değerler alabilir.
tabloya bağlantı
Oksidasyon durumu nasıl belirlenir? Periyodik tablo dikey olarak düzenlenmiş sekiz gruptan oluşur. Her birinin iki alt grubu vardır: ana ve ikincil. Öğeler için göstergeler ayarlamak için belirli kuralların kullanılması gerekir.
Talimat
Elementlerin oksidasyon durumları nasıl hesaplanır? Tablo, benzer bir problemle tamamen başa çıkmanıza izin verir. Birinci grupta (ana alt grup) yer alan alkali metaller, bileşiklerde oksidasyon durumunu gösterir, +'ya karşılık gelir, en yüksek değerliklerine eşittir. İkinci grubun metalleri (alt grup A) +2 oksidasyon durumuna sahiptir.
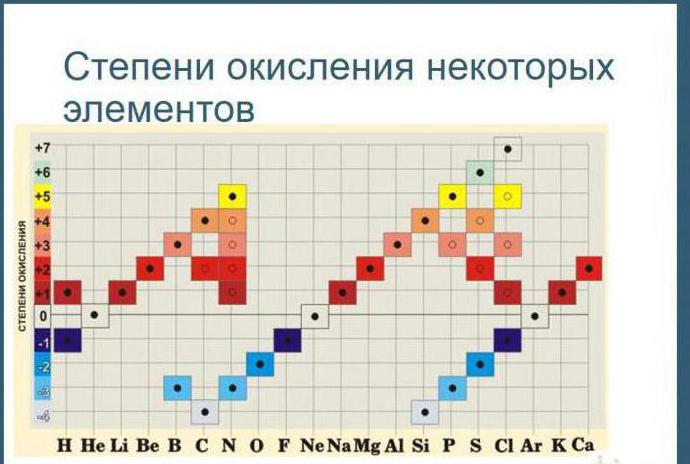
Tablo, bu değeri yalnızca metalik özellikler sergileyen elementler için değil, aynı zamanda metal olmayanlar için de belirlemenizi sağlar. Maksimum değerleri, en yüksek değerliğe karşılık gelecektir. Örneğin, kükürt için +6, nitrojen için +5 olacaktır. Minimum (en düşük) rakamları nasıl hesaplanır? Tablo da bu soruya cevap veriyor. Grup numarasını sekizden çıkarın. Örneğin oksijen için -2, nitrojen için -3 olacaktır.
Diğer maddelerle kimyasal etkileşime girmeyen basit maddeler için belirlenen gösterge sıfır olarak kabul edilir.
İkili bileşiklerdeki diziliş ile ilgili ana eylemleri belirlemeye çalışalım. Onlara oksidasyon derecesi nasıl eklenir? Periyodik tablo sorunu çözmeye yardımcı olur.
Örneğin, kalsiyum oksit CaO alın. İkinci grubun ana alt grubunda yer alan kalsiyum için değer +2'ye eşit sabit olacaktır. Metalik olmayan özelliklere sahip oksijen için bu gösterge negatif bir değer olacaktır ve -2'ye karşılık gelir. Tanımın doğruluğunu kontrol etmek için elde edilen sayıları özetliyoruz. Sonuç olarak sıfır alıyoruz, bu nedenle hesaplamalar doğru.
Bir tane daha ikili bileşik CuO'da benzer göstergeleri belirleyelim. Bakır ikincil bir alt grupta (birinci grup) bulunduğundan, incelenen gösterge şunları gösterebilir: Farklı anlamlar. Bu nedenle, belirlemek için önce oksijen göstergesini tanımlamanız gerekir.
İkili bir formülün sonunda yer alan bir ametal için oksidasyon durumu negatif bir değere sahiptir. Bu element altıncı grupta yer aldığından, sekizden altıyı çıkarırken oksijenin oksidasyon durumunun -2'ye karşılık geldiğini anlıyoruz. Bileşikte indeks olmadığından, bu nedenle bakırın oksidasyon durumu +2'ye eşit pozitif olacaktır.
Kimya tablosu başka nasıl kullanılır? Üç elementten oluşan formüllerdeki elementlerin yükseltgenme durumları da belli bir algoritmaya göre hesaplanır. İlk olarak, bu göstergeler ilk ve son öğeye yerleştirilir. İlk olarak, bu gösterge pozitif bir değere sahip olacaktır, değerliğe karşılık gelir. Metal olmayan aşırı element için bu gösterge negatif bir değere sahiptir, fark olarak belirlenir (grup numarası sekizden çıkarılır). Merkezi elementin oksidasyon durumunu hesaplarken matematiksel bir denklem kullanılır. Hesaplamalar, her bir öğe için mevcut olan endeksleri dikkate alır. Tüm oksidasyon durumlarının toplamı sıfır olmalıdır.
Sülfürik asitte belirleme örneği
Bu bileşiğin formülü H2S04'tür. Hidrojenin oksidasyon durumu +1'dir, oksijenin -2'si vardır. Sülfürün oksidasyon durumunu belirlemek için matematiksel bir denklem oluşturuyoruz: + 1 * 2 + X + 4 * (-2) = 0. Sülfürün oksidasyon durumunun +6'ya karşılık geldiğini anlıyoruz.
Çözüm
Kuralları kullanırken, katsayıları redoks reaksiyonlarında düzenleyebilirsiniz. Bu konu, okul müfredatının dokuzuncu sınıfının kimya dersinde ele alınmaktadır. Ek olarak, oksidasyon dereceleri hakkındaki bilgiler, OGE ve Birleşik Devlet Sınavı görevlerini tamamlamanıza olanak tanır.
Oksidasyon derecesi. Bir elementin atomunun oksidasyon durumunun bileşiğin kimyasal formülü ile belirlenmesi. Elementlerin atomlarının bilinen oksidasyon durumlarına göre bileşik formülünün derlenmesi
Bir elementin oksidasyon durumu, iyonlardan oluştuğu varsayımıyla hesaplanan bir maddedeki bir atomun koşullu yüküdür. Elementlerin oksidasyon derecesini belirlemek için belirli kuralları hatırlamak gerekir:
1. Oksidasyon durumu pozitif, negatif veya sıfır olabilir. Bu belirtilir Arap rakamı eleman sembolünün üzerinde artı veya eksi işareti olan.
2. Oksidasyon durumlarını belirlerken, maddenin elektronegatifliğinden hareket ederler: bileşikteki tüm atomların oksidasyon durumlarının toplamı sıfırdır.
3. Bileşik, bir elementin (basit bir maddede) atomlarından oluşuyorsa, bu atomların oksidasyon durumu sıfırdır.
4. Bazı kimyasal elementlerin atomlarına genellikle çeliğe oksidasyon durumları atanır. Örneğin, bileşiklerdeki florin oksidasyon durumu her zaman -1'dir; lityum, sodyum, potasyum, rubidyum ve sezyum +1; magnezyum, kalsiyum, stronsiyum, baryum ve çinko +2, alüminyum +3.
5. Çoğu bileşikte hidrojenin oksidasyon durumu +1'dir ve yalnızca bazı metallere sahip bileşiklerde -1'e eşittir (KH, BaH2).
6. Çoğu bileşikte oksijenin oksidasyon durumu -2'dir ve yalnızca bazı bileşiklerde -1 oksidasyon durumu atanır (H202 , Na202 veya +2 (OF2).
7. Birçok kimyasal elementin atomları değişken oksidasyon durumları sergiler.
8. Bileşiklerdeki bir metal atomunun oksidasyon durumu pozitiftir ve sayısal olarak değerliğine eşittir.
9. Bir elementin maksimum pozitif oksidasyon durumu, genellikle elementin bulunduğu periyodik sistemdeki grup sayısına eşittir.
10. Metaller için minimum oksidasyon durumu sıfırdır. Metal olmayanlar için, çoğu durumda, düşük negatif oksidasyon durumu, grup numarası ile sekiz sayısı arasındaki farka eşittir.
11. Bir atomun oksidasyon durumu, bu iyonun yüküne eşit basit bir iyon (bir atomdan oluşur) oluşturur.
Yukarıdaki kuralları kullanarak, H2S04 bileşimindeki kimyasal elementlerin oksidasyon durumlarını belirleriz. Bu, üç kimyasal elementten oluşan karmaşık bir maddedir - hidrojen H, kükürt S ve oksijen O. Sabit oldukları elementlerin oksidasyon durumlarını not ediyoruz. Bizim durumumuzda, bu hidrojen H ve oksijen O:.
Sülfürün bilinmeyen oksidasyon durumunu belirleyelim. Bu bileşikteki sülfürün oksidasyon durumu x: olsun.
Her elementin indeksini oksidasyon durumu ile çarparak denklemler yapalım ve çıkarılan miktarı sıfıra eşitleyelim: 2 (+1) + x + 4 (-2) = 0
Bu nedenle, sülfürün oksidasyon durumu artı altıdır:.
Aşağıdaki örnekte, ile bir bileşik formülü nasıl yazabileceğinizi öğreneceğiz. bilinen dereceler element atomlarının oksidasyonu. Ferrum (III) oksitin formülünü yapalım. "Oksit" kelimesi, demir sembolünün sağında oksijen sembolünün yazılması gerektiği anlamına gelir: FeO.
Sembollerinin üzerindeki kimyasal elementlerin oksidasyon durumlarına dikkat edin. Demirin oksidasyon durumu, adında parantez (III) içinde belirtilmiştir, bu nedenle +3'e eşittir, oksitlerdeki oksijenin oksidasyon durumu -2:.
3 ve 2 sayıları için en küçük ortak katı bulalım, bu 6'dır. 6 sayısını 3'e bölün, 2 sayısını elde ederiz - bu demirin indeksidir. 6 sayısını 2'ye bölün, 3 sayısını elde ederiz - bu oksijen indeksidir:.
Aşağıdaki örnekte, element atomlarının ve iyon yüklerinin bilinen oksidasyon durumları ile bir bileşik formülün nasıl formüle edileceğini öğrenelim. Kalsiyum ortofosfat formülü yapalım. "Ortofosfat" kelimesi, Kalsiyum sembolünün sağında ortofosfat asidinin asit kalıntısının CaPO 4 yazılması gerektiği anlamına gelir.
Kalsiyumun oksidasyon durumuna (kural dört) ve asit kalıntısının yüküne (çözünürlük tablosuna göre) dikkat edin:
2 ve 3 sayıları için en küçük ortak katı bulalım, bu 6'dır. 6 sayısını 2'ye bölün, 3 sayısını elde ederiz - bu kalsiyum indeksidir. 6 sayısını 3'e bölün, 2 sayısını elde ederiz - bu asit kalıntısının indeksidir:.
kristal kafesler
Kristal kafesler. Atomik, moleküler ve iyonik kristaller. Maddelerin fiziksel özelliklerinin kristal kafes tiplerine bağlılığı
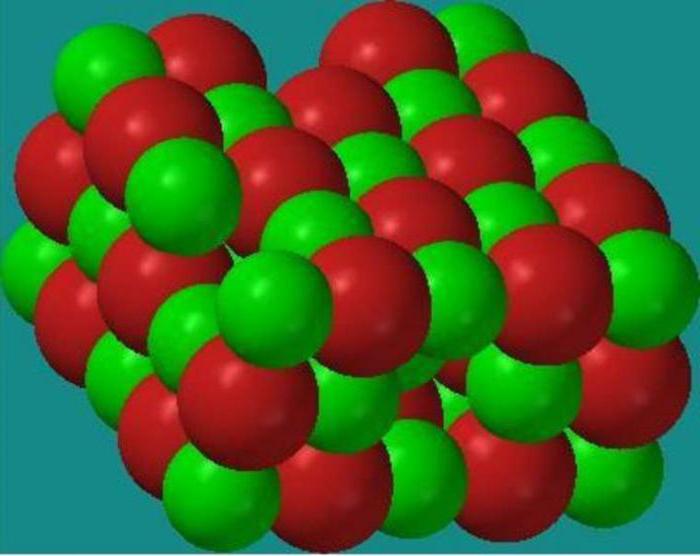
Kristal maddelerde atomlar, moleküller ve iyonlar belirli mesafelerde düzenli bir şekilde dizilirler. Kristallerdeki parçacıkların böyle düzenli bir düzenlemesine kristal kafes denir. Bu kafesin düğümlerinde hangi parçacıkların bulunduğuna bağlı olarak iyonik, atomik ve moleküler kristal kafesler ayırt edilir. Metalik kristal kafesler de bilinmektedir.
İyonik kristal kafesler, iyonik tipte bir kimyasal bağa sahip bileşiklerin karakteristiğidir. Bu tür kafeslerin yerlerinde zıt yüklü iyonlar bulunur. İnteriyonik etkileşim kuvvetleri çok önemlidir, bu nedenle bu tür kristal kafese sahip maddeler uçucu değildir, katıdır, refrakterdir, çözeltileri ve eriyikleri elektrik akımını iletir. Tipik temsilciler bu tür bileşikler tuzlardır, örneğin sodyum klorür, potasyum nitrat ve diğerleri.
Atomik kristal kafesler, kovalent tipte bir kimyasal bağa sahip bileşiklerin karakteristiğidir. Bu tür kafeslerin yerlerinde, kovalent bağlarla bağlanmış ayrı ayrı atomlar vardır. Tüm bağlar eşit ve güçlüdür, bu nedenle bu tür kristal kafese sahip maddeler yüksek sertlik ile karakterize edilir, yüksek sıcaklıklar erime, kimyasal eylemsizlik. Bu tür kristal kafes, elmas, silikon (IV) oksit, bor için tipiktir.
Moleküler kristal kafesler, kovalent tipte bir kimyasal bağa sahip bileşiklerin karakteristiğidir. Bu tür kafeslerin yerleri polar olmayan veya polar moleküller içerir. Zayıf etkileşim kuvvetleri nedeniyle, bu tür kristal kafese sahip maddeler düşük sertliğe, düşük erime ve kaynama noktalarına sahiptir ve uçuculuk ile karakterize edilir. Bu tür kristal kafes oksijen, iyot, su, glikoz, alkoller, naftalin için tipiktir.
Bu nedenle, kristal kafes tipi ve arasında belirli bir ilişki vardır. fiziki ozellikleri maddeler. Bu nedenle, bir maddenin yapısı biliniyorsa, o zaman özellikleri tahmin edilebilir ve tersine, bir maddenin özellikleri biliniyorsa, o zaman yapısı belirlenebilir.
Kovalent bağ, türleri - polar ve polar olmayan
Kovalent bağ, türleri - polar ve polar olmayan. Polar olmayan bir kovalent bağın oluşumu. Kovalent bir polar bağın oluşumu. Madde moleküllerinin elektronik formülleri
kovalent bağ elektron çiftlerinin ortaklaşa kullanılmasıyla oluşan kimyasal bağdır.
Bir hidrojen molekülü H2 örneğini kullanarak bir kovalent bağın oluşum mekanizmasını ele alalım. Hidrojen atomlarının elektronik bir formülü vardır: 1 H 1s 1 .
İki hidrojen atomu birbirine yaklaştığında, antiparalel dönüşlere sahip iki elektron (elektronlar farklı yönlerden oklarla gösterilir), ortak (paylaşılan) bir elektron çiftinin oluşumu ile etkileşime girer.
Bir kovalent bağın oluşumu için şema, dış seviyenin eşleşmemiş elektronunu bir noktayla ve ortak elektron çiftini iki noktayla göstererek temsil edilebilir. Ortak bir elektron çifti, yani genellikle bir çubukla gösterilen kovalent bağ. Hidrojen atomlarının s-orbitallerinin üst üste binmesi sonucu ortak bir elektron çifti oluşurken, üst üste binen orbitallerin olduğu bölgede artan bir elektron yoğunluğu oluşur.
Bir klor Cl2 molekülünde kovalent bağ oluşumunu düşünün. Klor atomlarının elektronik bir formülü vardır: 17 Cl 1s 2 2s 2 2p 6 3s 2 3p 5.
Klor atomunun dış enerji seviyesinde yedi elektronu vardır ve 3p alt seviyelerinde eşleşmemiş bir elektron vardır. İki klor atomu bir araya getirildiğinde, 3p orbitalleri eşleşmemiş elektronlarla örtüşür ve ortak bir elektron çifti oluşur. Cl2 molekülündeki her bir klor atomu, (bir atoma ait olan) üç paylaşılmamış elektron çifti depolar.
Hidrojen molekülü H2'de, klor molekülü Cl2'de olduğu gibi basit (tek) bir bağ oluşur. İki atom arasında iki veya üç elektron çiftinin göründüğü moleküller vardır. Bu tür kovalent bağlar, sırasıyla çift veya üçlü olarak adlandırılır. Çift ve üçlü bağların ortak adı çoklu bağlardır.
Örneğin, oksijen molekülü O2'de bir kovalent bağ oluşumunu düşünün. Oksijen atomlarının elektronik bir formülü vardır: 8 O 1s 2 2s 2 2p 4 .
Oksijen atomunun dış enerji seviyesinde altı elektron, 2p alt seviyelerinde ise iki eşleşmemiş elektron vardır. O2 molekülünde bir kimyasal bağın oluşumunda, her oksijen atomunun iki elektronu yer alır. İÇİNDE bu durum iki ortak elektron çifti (çift bağ) oluşur. O2 molekülündeki her oksijen atomu iki ortaklanmamış elektron çifti depolar.
Bir hidrojen molekülünde bir kovalent bağ oluştuğunda, hidrojen atomlarının her biri, ortak bir elektron çiftinin oluşumu nedeniyle kararlı bir iki elektronlu konfigürasyondur. Diğer durumlarda, örneğin klor ve oksijen moleküllerinde bir kovalent bağ oluştuğunda, atomların her biri sekiz elektrondan oluşan kararlı bir konfigürasyondur.
Dikkate alınan üç molekülün (hidrojen, klor ve oksijen) durumunda, aynı elektronegatifliğe sahip atomlar arasında bir kovalent bağ oluştu. Böyle bir etkileşim, molekülleri iki özdeş atomdan oluşan basit metal olmayan maddelerin oluşumu sırasında gözlenir. Bu durumda, ortak elektron çiftleri, atomların çekirdekleri arasında simetrik olarak bulunur, bağlanırlar. Sonuç olarak, pozitif ve negatif yük merkezlerinin çakıştığı moleküller oluşur.
Bu nedenle, ortak elektron çiftleri nedeniyle aynı elektronegatifliğe sahip atomlar arasında oluşan bir kovalent bağa polar olmayan kovalent bağ denir. Unutulmamalıdır ki bu tip kimyasal bağ basit ametal maddelerde oluşur. Kovalent polar olmayan tipte bir bağa sahip maddelere örnek olarak flor F2, brom Br2, iyot I2, nitrojen N2 denilebilir.
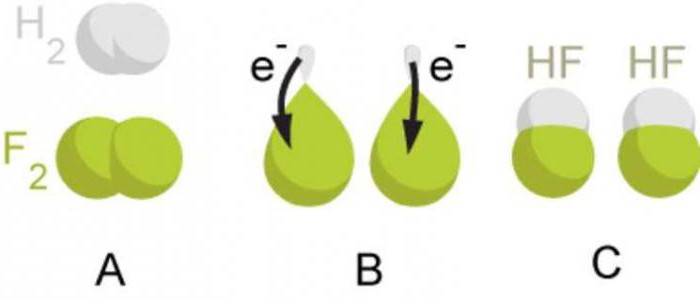
Etkileşen atomların farklı elektronegatiflikleri varsa (farklı kimyasal elementlerin atomları), paylaşılan elektron çifti daha büyük elektronegatifliğe sahip atoma doğru kayar. Bu durumda elektronegatifliği yüksek olan bir atomda kısmi negatif yük, elektronegatifliği düşük olan atomda kısmi pozitif yük oluşur. Bu kısmi yükler, mutlak değerde birlikten daha azdır.
Örneğin, bir hidrojen klorür molekülü (HCl) oluştuğunda, hidrojen atomunun s-yörüngesi ve klor atomunun p-yörüngesi üst üste biner. Paylaşılan elektron çifti, etkileşen atomların merkezlerine göre asimetrik olarak yerleştirilmiştir. Daha elektronegatif klora kayar. Klor atomunun kısmi negatif yükü vardır ve hidrojen atomunun kısmi pozitif yükü vardır. Bu durumda moleküldeki pozitif ve negatif yüklerin merkezleri çakışmaz. Bu tür moleküllere polar veya dipol denir. Bir dipol, büyüklükleri eşit fakat işaretleri zıt olan iki yük sistemidir.
Bu nedenle, elektronegatiflikleri farklı ancak çok az olan atomlar arasında oluşan bir kovalent bağa kovalent polar bağ denir. Bu tür kimyasal bağların metal olmayan atomların oluşturduğu karmaşık maddelerde oluştuğu unutulmamalıdır. Kovalent polar tipte bir bağa sahip maddelere örnek olarak, hidrojen florür HF, su H20, amonyak NH3, metan CH4, karbon (IV) oksit CO2 olarak adlandırılabilir.
Bir iyonik bağ, bir veya daha fazla elektronun bir atomdan diğerine tamamen aktarılmasıyla oluşur. Bu tür bir bağ, yalnızca elektronegatiflikleri önemli ölçüde farklı olan elementlerin atomları arasında mümkündür. Bu durumda, bir elektron, elektronegatifliği düşük olan bir atomdan, elektronegatifliği daha yüksek olan bir atoma geçer. Bu tür bir kimyasal bağın metal atomları ile metal olmayan atomlar arasında oluştuğu unutulmamalıdır. Örneğin, ana alt grupların birinci ve ikinci gruplarının elemanları periyodik sistem(tipik metaller), periyodik sistemin (tipik metal olmayanlar) ana alt gruplarının altıncı ve yedinci gruplarının elementleriyle doğrudan birleştirilir.
Potasyum klorür bileşiminde bir iyonik bağ oluşum mekanizmasını ele alalım. Potasyum atomu bir değerlik elektronu içerir (Potasyumun bulunduğu grubun sayısı ile belirlenir). Klor atomu yedi değerlik elektronu içerir (Klorun bulunduğu grubun sayısına göre belirlenir). Potasyum atomları klor atomları ile etkileştiğinde, potasyum atomunun değerlik elektronu tamamen klor atomunun dış seviyesine geçerek onu sekiz elektronlu bir yapıda tamamlar. Bu durumda, bir elektron kaybeden potasyum atomu +1 pozitif yük alır ve K + katyonuna dönüşür ve bir elektron ekleyerek klor atomu -1 negatif yük alır ve bir anyon Cl -'ye dönüşür. Zıt yüklü iyonlar elektrostatik kuvvetler nedeniyle çekilir ve potasyum klorür bileşiği oluşur. Bu süreç bir şema ile gösterilebilir:
Normal koşullar altında sadece bazı kimyasal elementler (soy gazlar) tek atomlu gaz halindedir. Diğer elementlerin atomları ise ayrı ayrı var olmazlar, atomların bir araya gelmesiyle oluşan moleküllerin veya kristal kafeslerin parçasıdırlar. Yani, atomların birbirine bağlanmasının bir nedeni var. Bu sebep kimyasal bağdır, çünkü atomlar arasında atomları birbirine tutabilen belirli elektrostatik kuvvetler vardır. Atomlar arasında bir kimyasal bağın oluşumunda olduğu kanıtlanmıştır. ana rol değerlik elektronlarına aittir (çekirdekle zayıf bir şekilde ilişkili dış seviyenin elektronları).
Kimyasal bağ teorisine göre, iki veya sekiz elektrondan oluşan dış kabuklar en büyük güce sahiptir. Soy gazların böyle elektron kabukları vardır. Soy gazların normal şartlar altında diğer elementlerle kimyasal reaksiyona girmemesinin nedeni budur. Dış katmanlarında sekizden (veya ikiden) az elektron bulunan atomlar, soy gaz yapıları elde etmeye çalışırlar. Bu nedenle, bir kimyasal reaksiyon sırasında bir molekül oluştuğunda, atomlar kararlı bir sekiz elektronlu veya iki elektronlu bir kabuk elde etmeye çalışır.
Kararlı bir elektronik konfigürasyonun oluşumu çeşitli şekillerde meydana gelebilir ve çeşitli yapılarda moleküllerin veya moleküler olmayan bileşiklerin oluşumuna yol açabilir. Sonuç olarak, kovalent ve iyonik kimyasal bağ türleri ayırt edilir. Bu türlere ek olarak, başka kimyasal bağ türleri de vardır: metalik ve hidrojen (moleküller arası).
Bileşiklerdeki bir atomun formal yükü yardımcı bir niceliktir, genellikle kimyada elementlerin özelliklerinin tanımlanmasında kullanılır. Bu koşullu elektrik yükü oksidasyon derecesidir. Birçok kimyasal işlem sonucunda değeri değişir. Yük resmi olmasına rağmen, redoks reaksiyonlarında (ORD'ler) atomların özelliklerini ve davranışını canlı bir şekilde karakterize eder.
Oksidasyon ve indirgeme
Geçmişte kimyagerler, oksijenin diğer elementlerle etkileşimini tanımlamak için "oksidasyon" terimini kullandılar. Reaksiyonların adı, oksijenin Latince adından gelir - Oxygenium. Daha sonra diğer elementlerin de oksitlendiği ortaya çıktı. Bu durumda, geri yüklenirler - elektronları bağlarlar. Bir molekülün oluşumu sırasında her atom, değerlik elektron kabuğunun yapısını değiştirir. Bu durumda, değeri koşullu olarak verilen veya alınan elektronların sayısına bağlı olan resmi bir yük ortaya çıkar. Bu değeri karakterize etmek için, çeviride "oksidasyon numarası" anlamına gelen İngilizce kimyasal terim "oksidasyon numarası" daha önce kullanılmıştır. Bunu kullanırken, moleküllerdeki veya iyonlardaki bağlayıcı elektronların daha fazlasına sahip bir atoma ait olduğu varsayımından hareket ederler. yüksek değer elektronegatiflik (EO). Elektronlarını tutma ve onları diğer atomlardan çekme yeteneği, güçlü metal olmayanlarda (halojenler, oksijen) iyi ifade edilir. Güçlü metaller (sodyum, potasyum, lityum, kalsiyum, diğer alkali ve toprak alkali elementler) zıt özelliklere sahiptir.
Oksidasyon derecesinin belirlenmesi
Oksidasyon durumu, bağ oluşumunda yer alan elektronlar tamamen daha elektronegatif bir elemente kaydırılırsa, bir atomun kazanacağı yüktür. Moleküler yapıya sahip olmayan maddeler (alkali metal halojenürler ve diğer bileşikler) vardır. Bu durumlarda, oksidasyon durumu iyonun yükü ile çakışır. Koşullu veya gerçek yük, atomların mevcut durumlarını kazanmadan önce hangi sürecin gerçekleştiğini gösterir. Pozitif oksidasyon durumu, atomlardan çıkarılan toplam elektron sayısıdır. olumsuz anlam oksidasyon durumu, edinilen elektronların sayısına eşittir. Bir kimyasal elementin oksidasyon durumunu değiştirerek, reaksiyon sırasında atomlarına ne olduğu (ve tersi) yargılanır. Maddenin rengi, oksidasyon durumunda meydana gelen değişiklikleri belirler. Farklı değerler sergiledikleri krom, demir ve diğer bazı elementlerin bileşikleri farklı şekilde renklendirilir.
Negatif, sıfır ve pozitif oksidasyon durumu değerleri

Basit maddeler oluşur kimyasal elementlerİle aynı değer EO. Bu durumda, bağ elektronları tüm yapısal parçacıklara eşit olarak aittir. Bu nedenle basit maddelerde oksidasyon durumu (H 0 2, O 0 2, C 0) elementlerin özelliği değildir. Atomlar elektronları kabul ettiğinde veya genel bulut yön değiştirdiğinde, yükleri eksi işaretiyle yazmak adettendir. Örneğin, F -1, O -2, C -4. Elektronları bağışlayarak, atomlar gerçek veya resmi bir pozitif yük kazanır. OF 2 oksitte, oksijen atomu iki flor atomuna birer elektron verir ve O +2 oksidasyon durumundadır. Bir molekülde veya çok atomlu bir iyonda, daha elektronegatif atomların tüm bağlayıcı elektronları aldığına inanılmaktadır.
Kükürt, farklı değerler ve oksidasyon durumları sergileyen bir elementtir.
Ana alt grupların kimyasal elementleri genellikle VIII'e eşit daha düşük bir değer sergiler. Örneğin, hidrojen sülfür ve metal sülfürlerdeki sülfürün değerliği II'dir. Eleman, atom bir, iki, dört veya altı elektronun tümünü verdiğinde ve sırasıyla I, II, IV, VI değerlerini gösterdiğinde, uyarılmış durumda orta ve daha yüksek değerlerle karakterize edilir. Yalnızca eksi veya artı işareti olan aynı değerler, sülfürün oksidasyon durumlarına sahiptir:
- flor sülfürde bir elektron verir: -1;
- hidrojen sülfürde en düşük değer: -2;
- dioksit ara durumunda: +4;
- trioksit, sülfürik asit ve sülfatlarda: +6.
En yüksek oksidasyon durumunda, kükürt yalnızca elektronları kabul eder; en düşük durumunda, güçlü indirgeme özellikleri sergiler. S +4 atomları, koşullara bağlı olarak bileşiklerde indirgeyici veya oksitleyici maddeler olarak işlev görebilir.
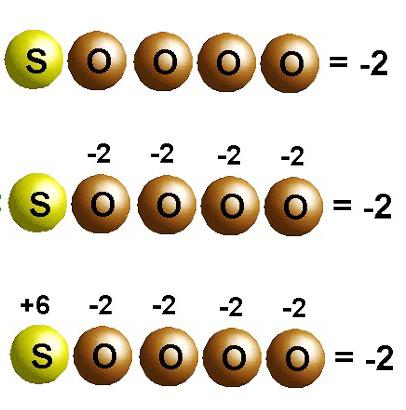
Kimyasal reaksiyonlarda elektron transferi
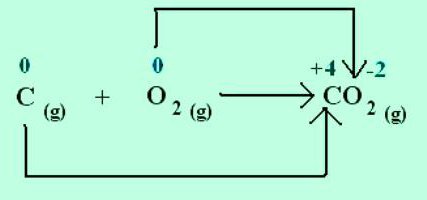
Bir sodyum klorür kristalinin oluşumunda, sodyum daha elektronegatif olan klora elektron verir. Elementlerin oksidasyon durumları iyonların yükleri ile örtüşür: Na +1 Cl-1 . Elektron çiftlerinin sosyalleşmesi ve daha elektronegatif bir atoma yer değiştirmesiyle oluşturulan moleküller için, yalnızca resmi bir yük kavramı uygulanabilir. Ancak tüm bileşiklerin iyonlardan oluştuğu varsayılabilir. Daha sonra atomlar, elektronları çekerek koşullu bir negatif yük kazanırlar ve vererek, pozitif bir yük kazanırlar. Tepkimelerde kaç elektronun yer değiştirdiğini gösteriniz. Örneğin, karbon dioksit molekülü C +4 O - 2 2'de, karbon için kimyasal sembolün sağ üst köşesinde gösterilen indeks, atomdan koparılan elektron sayısını gösterir. Bu maddedeki oksijenin oksidasyon durumu -2'dir. O kimyasal işaretine karşılık gelen indeks, atomda eklenen elektronların sayısıdır.
Oksidasyon durumları nasıl hesaplanır
Atomlar tarafından bağışlanan ve eklenen elektronların sayısını saymak zaman alıcı olabilir. Aşağıdaki kurallar bu görevi kolaylaştırır:
- Basit maddelerde oksidasyon durumları sıfırdır.
- Nötr bir maddedeki tüm atomların veya iyonların oksidasyonunun toplamı sıfırdır.
- Karmaşık bir iyonda, tüm elementlerin oksidasyon durumlarının toplamı, tüm parçacığın yüküne karşılık gelmelidir.
- Daha elektronegatif bir atom, eksi işaretiyle yazılan negatif bir oksidasyon durumu kazanır.
- Daha az elektronegatif elementler pozitif oksidasyon durumları alırlar, artı işaretiyle yazılırlar.
- Oksijen genellikle -2'lik bir oksidasyon durumu sergiler.
- hidrojen için karakteristik değer: +1, metal hidritlerde bulunur: H-1.
- Flor, tüm elementlerin en elektronegatifidir, oksidasyon durumu her zaman -4'tür.
- Çoğu metal için oksidasyon sayıları ve değerleri aynıdır.

Oksidasyon durumu ve değerlik
Bileşiklerin çoğu redoks işlemlerinin bir sonucu olarak oluşur. Elektronların bir elementten diğerine geçişi veya yer değiştirmesi, oksidasyon durumlarında ve değerliklerinde bir değişikliğe yol açar. Genellikle bu değerler çakışır. "Oksidasyon durumu" teriminin eşanlamlısı olarak "elektrokimyasal değerlik" ifadesi kullanılabilir. Ancak istisnalar vardır, örneğin amonyum iyonunda nitrojen dört değerlidir. Aynı zamanda, bu elementin atomu -3 oksidasyon durumundadır. Organik maddelerde karbon her zaman dört değerlidir, ancak C atomunun metan CH4, formik alkol CH3OH ve HCOOH asit içindeki oksidasyon durumları farklı değerlere sahiptir: -4, -2 ve +2.
redoks reaksiyonları

Birçok redoks kritik süreçler sanayide, teknolojide, yaşamda ve cansız doğa: yanma, korozyon, fermantasyon, hücre içi solunum, fotosentez ve diğer olaylar.
GEN denklemlerini derlerken katsayılar, aşağıdaki kategorilerin çalıştırıldığı elektronik denge yöntemi kullanılarak seçilir:
- oksidasyon durumları;
- indirgeyici madde elektron verir ve oksitlenir;
- oksitleyici madde elektronları kabul eder ve indirgenir;
- Verilen elektronların sayısı bağlı olanların sayısına eşit olmalıdır.
Elektronların bir atom tarafından kazanılması, oksidasyon durumunda bir azalmaya (indirgeme) yol açar. Bir atomun bir veya daha fazla elektron kaybetmesine, reaksiyonlar sonucunda elementin oksidasyon sayısının artması eşlik eder. OVR için, sulu çözeltilerde güçlü elektrolitlerin iyonları arasında akan elektronik terazi değil, daha çok yarı reaksiyon yöntemi kullanılır.
Şunları okumak faydalı olabilir:
- yurt dışında tedavi korkma Yurtdışında tedavi - medikal turizmin ana yönleri Yurtdışında daha iyi tedavi;
- Bir sorum var: Stresten nasıl kurtulurum?;
- Romina Power Albano Carrisi çocuklarının hayatındaki ana trajediler ne yapıyorlar?;
- Çocuk anaokulunda arkadaş olmak istemiyorsa ne yapmalı?;
- Kişniş - kullanışlı özellikler ve uygulama Kozmetolojide kişniş esansiyel yağı;
- Lahana turşusu ile klasik salata sosu - fotoğraflı adım adım tarif;
- Sağlıklı bir vücutta sağlıklı bir zihinde mi?;
- Bir emeklinin işten çıkarılması prosedürü: mevcut gerekçeler ve kısıtlamalar ve haklarınızı nasıl koruyabilirsiniz?;