Eng past oksidlanish darajasini qanday hisoblash mumkin. Oksidlanish darajasi qanday? Elementlarning oksidlanish darajasini qanday aniqlash mumkin?
Bunday element maktab o'quv dasturi Kimyo ko'pgina zamonaviy maktab o'quvchilari uchun juda ko'p qiyinchiliklarni keltirib chiqarganligi sababli, aralashmalardagi oksidlanish darajasini kam odam aniqlay oladi. Eng katta qiyinchiliklar noorganik kimyoni o'rganadigan maktab o'quvchilari, ya'ni asosiy maktab o'quvchilari (8-9-sinflar). Mavzuni noto'g'ri tushunish talabalar o'rtasida ushbu fanga dushmanlik paydo bo'lishiga olib keladi.
O'qituvchilar o'rta va o'rta maktab o'quvchilarining kimyo fanini bunday "yoqmasligi" uchun bir qator sabablarni aniqlaydilar: murakkab kimyoviy atamalarni tushunishni istamaslik, muayyan jarayonni ko'rib chiqish uchun algoritmlardan foydalana olmaslik, matematik bilimlar bilan bog'liq muammolar. Rossiya Federatsiyasi Ta'lim vazirligi fanning mazmuniga jiddiy o'zgarishlar kiritdi. Bundan tashqari, kimyo o‘qitish soatlari ham “qisqartirilgan”. Bu fan bo'yicha bilim sifatiga salbiy ta'sir ko'rsatdi, fanni o'rganishga qiziqishning pasayishiga olib keldi.
Kimyo kursining qaysi mavzulari maktab o'quvchilari uchun eng qiyin?
tomonidan yangi dastur asosiy maktabning "Kimyo" o'quv fanining kursi bir nechta jiddiy mavzularni o'z ichiga oladi: D. I. Mendeleev elementlarining davriy jadvali, noorganik moddalar sinflari, ion almashinuvi. Sakkizinchi sinf o'quvchilari uchun eng qiyin narsa - oksidlarning ta'rifi.
Joylashtirish qoidalari
Avvalo, talabalar oksidlar kislorodni o'z ichiga olgan murakkab ikki elementli birikmalar ekanligini bilishlari kerak. Old shart ikkilik birikmaning oksidlar sinfiga mansubligi kislorodning bu birikmadagi ikkinchi joylashuvidir.
Kislota oksidi algoritmi
Boshlash uchun shuni ta'kidlaymizki, oksidlanish darajalari elementlarning valentligining raqamli ifodasidir. valentligi to'rtdan ettigacha bo'lgan metall bo'lmagan yoki metallar tomonidan hosil qilingan, bunday oksidlarda ikkinchisi, albatta, kisloroddir.
Oksidlarda kislorodning valentligi har doim ikkitaga to'g'ri keladi, uni D. I. Mendeleev elementlarining davriy tizimidan aniqlash mumkin. Davriy jadvalning asosiy kichik guruhining 6-guruhida bo'lgan kislorod kabi odatiy metall bo'lmagan metall tashqi energiya darajasini to'liq bajarish uchun ikkita elektronni qabul qiladi. Kislorodli birikmalardagi metall bo'lmaganlar ko'pincha yuqori valentlikni namoyon qiladi, bu guruhning o'zi soniga to'g'ri keladi. Shuni esda tutish kerakki, kimyoviy elementlarning oksidlanish darajasi ijobiy (salbiy) raqamni bildiruvchi ko'rsatkichdir.
Formulaning boshida joylashgan metall bo'lmaganlar ijobiy oksidlanish darajasiga ega. Metall bo'lmagan kislorod oksidlarda barqaror, uning indeksi -2 ga teng. Kislota oksidlarida qiymatlarni joylashtirishning ishonchliligini tekshirish uchun siz o'rnatgan barcha raqamlarni ma'lum bir elementning indekslari bilan ko'paytirishingiz kerak bo'ladi. Belgilangan darajalarning barcha ortiqcha va kamchiliklarining umumiy yig'indisi 0 bo'lsa, hisob-kitoblar ishonchli hisoblanadi.

Ikki elementli formulalar tuzish
Elementlar atomlarining oksidlanish darajasi ikki elementdan birikmalar hosil qilish va qayd etish imkonini beradi. Formulani yaratishda, boshlanuvchilar uchun ikkala belgi yonma-yon yoziladi, kislorodni ikkinchi o'ringa qo'yishni unutmang. Har bir qayd etilgan belgilarning ustida oksidlanish darajasining qiymatlari belgilanadi, so'ngra topilgan raqamlar orasida qoldiqsiz ikkala raqamga bo'linadigan raqam mavjud. Bu ko'rsatkich ikki elementli moddaning birinchi va ikkinchi komponentlari uchun indekslarni olish, oksidlanish darajasining raqamli qiymatiga alohida bo'linishi kerak. Eng yuqori oksidlanish darajasi oddiy metall bo'lmaganning eng yuqori valentligining qiymatiga son jihatdan teng bo'lib, PSda metall bo'lmaganlar joylashgan guruh raqamiga o'xshashdir.
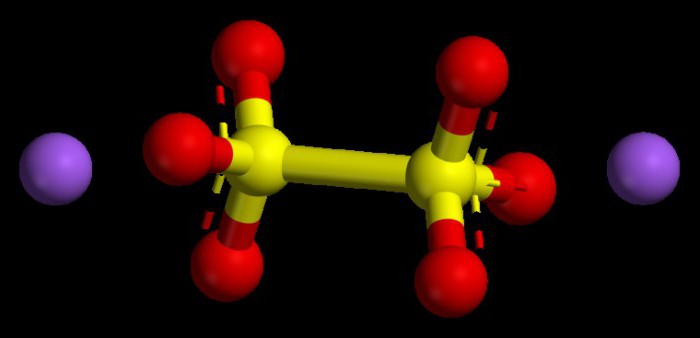
Asosiy oksidlarda raqamli qiymatlarni o'rnatish algoritmi
Bunday birikmalarga tipik metallarning oksidlari kiradi. Ular barcha birikmalarda +1 yoki +2 dan oshmaydigan oksidlanish darajasi indeksiga ega. Metallning oksidlanish darajasi qanday bo'lishini tushunish uchun siz davriy jadvaldan foydalanishingiz mumkin. Birinchi guruhning asosiy kichik guruhlari metallari uchun bu parametr doimo doimiy bo'lib, u guruh raqamiga o'xshaydi, ya'ni +1.
Ikkinchi guruhning asosiy kichik guruhidagi metallar ham barqaror oksidlanish darajasi bilan tavsiflanadi, son jihatdan +2. Oksidlarning oksidlanish darajalari, ularning indekslarini (raqamlarini) hisobga olgan holda, nolga teng bo'lishi kerak, chunki kimyoviy molekula neytral, zaryadsiz zarracha hisoblanadi.
Kislorodli kislotalarda oksidlanish darajalarining joylashishi
Kislotalar bir yoki bir nechta vodorod atomlaridan tashkil topgan murakkab moddalar bo'lib, ular qandaydir kislota qoldiqlari bilan bog'liq. Oksidlanish darajalari raqamlar ekanligini hisobga olsak, ularni hisoblash uchun ba'zi matematik ko'nikmalar talab qilinadi. Kislotalardagi vodorod (proton) uchun bunday ko'rsatkich har doim barqaror, u +1. Keyinchalik, salbiy kislorod ioni uchun oksidlanish holatini belgilashingiz mumkin, u ham barqaror, -2.
Faqatgina ushbu harakatlardan so'ng, formulaning markaziy komponentining oksidlanish darajasini hisoblash mumkin. Muayyan namuna sifatida H2SO4 sulfat kislotadagi elementlarning oksidlanish darajasini aniqlashni ko'rib chiqing. Bu murakkab moddaning molekulasida ikkita vodorod protoni, 4 ta kislorod atomi borligini hisobga olsak, bu shakldagi +2+X-8=0 ifodasini olamiz. Yig'indi nolga teng bo'lishi uchun oltingugurt +6 oksidlanish darajasiga ega bo'ladi
Tuzlarda oksidlanish darajalarining joylashishi
Tuzlar metall ionlari va bir yoki bir nechta kislota qoldiqlaridan tashkil topgan murakkab birikmalardir. Har birining oksidlanish darajasini aniqlash usuli tarkibiy qismlar murakkab tuzda kislorodli kislotalar bilan bir xil bo'ladi. Elementlarning oksidlanish darajasi raqamli ko'rsatkich ekanligini hisobga olsak, metallning oksidlanish darajasini to'g'ri ko'rsatish muhimdir.
Agar tuz hosil qiluvchi metall asosiy kichik guruhda joylashgan bo'lsa, uning oksidlanish darajasi barqaror bo'ladi, guruh raqamiga mos keladi, ijobiy qiymatdir. Agar tuz tarkibida xuddi shunday PS kichik guruhining metalli bo'lsa, kislota qoldig'i bilan turli metallarni ko'rsatish mumkin. Metallning oksidlanish darajasi o'rnatilgandan so'ng, (-2) qo'ying, so'ngra kimyoviy tenglama yordamida markaziy elementning oksidlanish darajasi hisoblanadi.
Misol tariqasida (o'rta tuz) elementlarning oksidlanish darajalarini aniqlashni ko'rib chiqing. NaNO3. Tuz 1-guruhning asosiy kichik guruhining metallidan hosil bo'ladi, shuning uchun natriyning oksidlanish darajasi +1 bo'ladi. Nitratlardagi kislorod -2 oksidlanish darajasiga ega. Oksidlanish darajasining son qiymatini aniqlash uchun +1+X-6=0 tenglama olinadi. Ushbu tenglamani yechib, X ning +5 bo'lishi kerakligini tushunamiz, bu

OVRdagi asosiy atamalar
Oksidlanish va qaytarilish jarayoni uchun talabalar o'rganishi kerak bo'lgan maxsus atamalar mavjud.
Atomning oksidlanish darajasi - uning ba'zi ionlar yoki atomlardan elektronlarni o'ziga biriktirish (boshqalarga berish) qobiliyatidir.
Neytral atomlar yoki zaryadlangan ionlar oksidlovchi vosita hisoblanadi. kimyoviy reaksiya elektronlarni qabul qilish.
Qaytaruvchi vosita kimyoviy o'zaro ta'sir jarayonida o'z elektronlarini yo'qotadigan zaryadsiz atomlar yoki zaryadlangan ionlar bo'ladi.
Oksidlanish elektronlarni berish tartibi sifatida taqdim etiladi.
Qaytarilish zaryadsiz atom yoki ion tomonidan qo'shimcha elektronlarni qabul qilish bilan bog'liq.
Oksidlanish-qaytarilish jarayoni atomning oksidlanish darajasi majburiy ravishda o'zgarib turadigan reaktsiya bilan tavsiflanadi. Ushbu ta'rif sizga reaktsiyaning OVR ekanligini qanday aniqlash mumkinligini tushunishga imkon beradi.

OVR tahlil qilish qoidalari
Ushbu algoritm yordamida siz har qanday kimyoviy reaktsiyadagi koeffitsientlarni tartibga solishingiz mumkin.
Oxirgi bosqich ko'rib chiqilayotgan reaktsiyadagi stereokimyoviy koeffitsientlarni tartibga solish bo'ladi.
OVR misoli
Avval siz har bir kimyoviy moddada oksidlanish darajasini tartibga solishingiz kerak. E'tibor bering, oksidlanish darajasi nolga teng, chunki salbiy zarralarning qaytishi (birikmasi) yo'q. Ikkilik va uch elementli moddalarda oksidlanish darajalarini joylashtirish qoidalarini biz yuqorida muhokama qildik.
Keyin siz transformatsiya paytida oksidlanish darajasi o'zgargan atomlar yoki ionlarni aniqlashingiz kerak.
Yozma tenglamaning chap tomonida oksidlanish darajasini o'zgartirgan atomlar yoki zaryadlangan ionlar ajratiladi. Bu balans uchun zarurdir. Elementlarning tepasida ularning qiymatlari ko'rsatilishi kerak.
Bundan tashqari, reaktsiya paytida hosil bo'lgan atomlar yoki ionlar + belgisi bilan belgilanadi, atom tomonidan qabul qilingan elektronlar soni - berilgan manfiy zarralar soni. Agar o'zaro ta'sir jarayonidan keyin oksidlanish darajasi pasaysa. Bu elektronlar atom (ion) tomonidan qabul qilinganligini bildiradi. Oksidlanish darajasining oshishi bilan atom (ion) reaksiya jarayonida elektronlarni beradi.
Eng kam umumiy soni avval olingan elektronlarga, so'ngra jarayonda berilgan elektronlarga bo'linib, koeffitsientlar olinadi. Topilgan raqamlar kerakli stereokimyoviy koeffitsientlar bo'ladi.
Oksidlovchi, qaytaruvchi, reaksiya jarayonida sodir bo'ladigan jarayonlarni aniqlang.
Muayyan kimyoviy reaktsiya uchun ushbu algoritmning amaliy qo'llanilishini ko'rib chiqing.
Fe+CuSO4=Cu+FeSO4
Biz barcha oddiy va murakkab moddalar uchun ko'rsatkichlarni hisoblaymiz.
Fe va Cu oddiy moddalar bo'lganligi uchun ularning oksidlanish darajasi 0. CuSO4 da, keyin Cu + 2, keyin kislorodda -2, oltingugurtda +6 bo'ladi. FeSO4 da: Fe +2, shuning uchun O-2 uchun, S +6 hisob-kitoblariga ko'ra.
Endi biz ko'rsatkichlarni o'zgartirishi mumkin bo'lgan elementlarni qidirmoqdamiz, bizning vaziyatimizda ular Fe va Cu bo'ladi.
Reaksiyadan so'ng temir atomining qiymati +2 bo'lganligi sababli reaksiyada 2 ta elektron berildi. Mis o'z ko'rsatkichlarini +2 dan 0 ga o'zgartirdi, shuning uchun mis 2 ta elektronni qabul qildi. Endi temir atomi va ikki valentli mis kationi tomonidan qabul qilingan va berilgan elektronlar sonini aniqlaymiz. Transformatsiya jarayonida ikki valentli mis kationi ikkita elektronni oldi va temir atomi tomonidan bir xil miqdordagi elektronlar berildi.
Ushbu jarayonda minimal umumiy ko'paytmani aniqlashning ma'nosi yo'q, chunki transformatsiya paytida teng miqdordagi elektronlar olinadi va beriladi. Stereokimyoviy koeffitsientlar ham birlikka mos keladi. Reaksiyada temir oksidlangan holda qaytaruvchining xususiyatlarini ko'rsatadi. Ikki valentli mis kationi reaksiyada sof misga qaytariladi eng yuqori daraja oksidlanish.

Jarayonlarni qo'llash
Oksidlanish darajasi formulalari 8-9-sinflarda har bir o'quvchiga ma'lum bo'lishi kerak, chunki bu masala OGE topshiriqlari. Oksidlanish, qaytaruvchi belgilar bilan davom etadigan har qanday jarayonlar o'ynaydi ahamiyati hayotimizda. Ularsiz inson organizmidagi metabolik jarayonlar mumkin emas.
I qism
1. Oksidlanish darajasi (s. o.) hisoblanadi murakkab moddadagi kimyoviy element atomlarining oddiy ionlardan iborat degan taxmin asosida hisoblangan shartli zaryadi.
Bilish kerak!
1) bilan aloqada. O. vodorod = +1, gidridlardan tashqari.
2) bilan birikmalarda. O. kislorod = -2, peroksidlar bundan mustasno ![]() va ftoridlar
va ftoridlar
3) Metalllarning oksidlanish darajasi doimo musbat.
Birinchi uchta guruhning asosiy kichik guruhlari metallari uchun Bilan. O. doimiy:
IA guruhi metallari - p. O. = +1,
IIA guruhi metallari - p. O. = +2,
IIIA guruhi metallari - p. O. = +3.
4) Erkin atomlar va oddiy moddalar uchun p. O. = 0.
5) Jami s. O. birikmadagi barcha elementlar = 0.
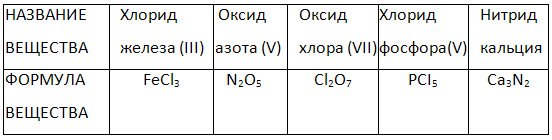
2. Ismlarning yasalish usuli ikki elementli (ikkilik) birikmalar.

4. “Binar birikmalarning nomlari va formulalari” jadvalini to‘ldiring.
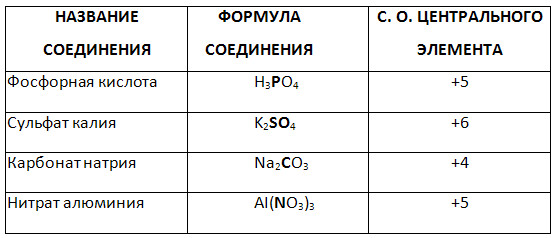
5. Kompleks birikmaning ajratilgan elementining oksidlanish darajasini aniqlang.
II qism
1. Formulalari bo'yicha birikmalardagi kimyoviy elementlarning oksidlanish darajalarini aniqlang. Ushbu moddalarning nomlarini yozing.

2. FeO, Fe2O3, CaCl2, AlBr3, CuO, K2O, BaCl2, SO3 moddalarini ajratib oling.ikki guruhga. Oksidlanish darajasini ko'rsatuvchi moddalarning nomlarini yozing.

3. Kimyoviy element atomining nomi va oksidlanish darajasi va birikma formulasi o‘rtasidagi muvofiqlikni aniqlang.

4. Nomlari bo'yicha moddalar formulalarini tuzing.

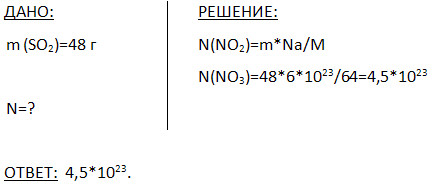
5. 48 g oltingugurt oksidi (IV) tarkibida nechta molekula bor?
6. Internet va boshqa axborot manbalaridan foydalanib, quyidagi reja bo'yicha har qanday ikkilik ulanishdan foydalanish bo'yicha hisobot tayyorlang:
1) formula;
2) ism;
3) xususiyatlar;
4) ariza.
H2O suv, vodorod oksidi.
Suv da normal sharoitlar suyuq, rangsiz, hidsiz, qalin qatlamda - ko'k. Qaynash nuqtasi taxminan 100⁰S. Bu yaxshi hal qiluvchi. Suv molekulasi ikkita vodorod atomi va bitta kislorod atomidan iborat bo'lib, bu uning sifat va miqdoriy tarkibi. Bu murakkab modda bo'lib, u quyidagilar bilan tavsiflanadi Kimyoviy xossalari: ishqoriy metallar, gidroksidi tuproq metallari bilan o'zaro ta'siri. Suv bilan almashinish reaksiyalariga gidroliz deyiladi. Bu reaktsiyalar mavjud katta ahamiyatga ega kimyoda.
7. K2MnO4 birikmasidagi marganetsning oksidlanish darajasi:
3) +6
8. Formulasi quyidagi birikmada xrom eng past oksidlanish darajasiga ega:
1) Cr2O3
9. Formulasi quyidagicha bo'lgan birikmada xlor maksimal oksidlanish darajasini ko'rsatadi:
3) Sl2O7
Oksidlanish darajasini qanday aniqlash mumkin? Davriy jadval har qanday kimyoviy element uchun berilgan miqdoriy qiymatni qayd etish imkonini beradi.
Ta'rif
Birinchidan, keling, bu atama nima ekanligini tushunishga harakat qilaylik. Davriy jadvalga ko'ra oksidlanish darajasi - bu kimyoviy o'zaro ta'sir jarayonida element tomonidan qabul qilingan yoki berilgan elektronlar soni. U ham salbiy, ham ijobiy qiymatlarni qabul qilishi mumkin.
Jadvalga havola
Oksidlanish darajasi qanday aniqlanadi? Davriy jadval vertikal ravishda joylashgan sakkiz guruhdan iborat. Ularning har biri ikkita kichik guruhga ega: asosiy va ikkilamchi. Elementlar uchun ko'rsatkichlarni o'rnatish uchun ma'lum qoidalardan foydalanish kerak.
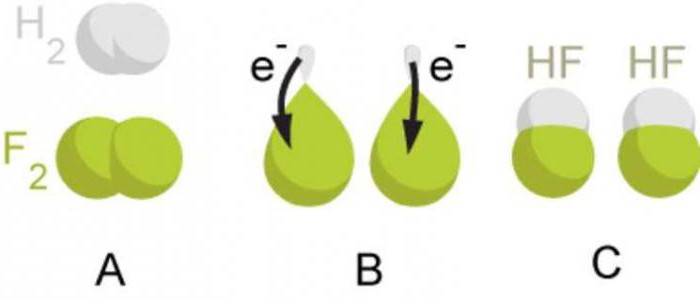
Ko'rsatma
Elementlarning oksidlanish darajalarini qanday hisoblash mumkin? Jadval shunga o'xshash muammoni to'liq engishga imkon beradi. Birinchi guruh (asosiy kichik guruh)da joylashgan gidroksidi metallar birikmalarda oksidlanish darajasini ko'rsatadi, u + ga to'g'ri keladi, ularning eng yuqori valentligiga teng. Ikkinchi guruh metallari (A kichik guruhi) +2 oksidlanish darajasiga ega.
Jadval bu qiymatni nafaqat metall xususiyatlarini ko'rsatadigan elementlar uchun, balki metall bo'lmaganlar uchun ham aniqlash imkonini beradi. Ularning maksimal qiymati eng yuqori valentlikka mos keladi. Masalan, oltingugurt uchun u +6, azot uchun +5 bo'ladi. Ularning minimal (eng past) ko'rsatkichi qanday hisoblanadi? Jadval ham bu savolga javob beradi. Guruh raqamini sakkizdan ayirish. Masalan, kislorod uchun -2, azot uchun -3 bo'ladi.
Boshqa moddalar bilan kimyoviy o'zaro ta'sirga kirmagan oddiy moddalar uchun belgilangan ko'rsatkich nolga teng deb hisoblanadi.
Keling, binar birikmalarda joylashish bilan bog'liq asosiy harakatlarni aniqlashga harakat qilaylik. Ularga oksidlanish darajasini qanday qo'yish mumkin? Davriy jadval muammoni hal qilishga yordam beradi.
Masalan, kaltsiy oksidi CaO ni oling. Ikkinchi guruhning asosiy kichik guruhida joylashgan kaltsiy uchun qiymat doimiy bo'ladi, +2 ga teng. Metall bo'lmagan xususiyatlarga ega bo'lgan kislorod uchun bu ko'rsatkich salbiy qiymat bo'ladi va u -2 ga to'g'ri keladi. Ta'rifning to'g'riligini tekshirish uchun biz olingan raqamlarni umumlashtiramiz. Natijada, biz nolga erishamiz, shuning uchun hisob-kitoblar to'g'ri.
Shu kabi ko'rsatkichlarni yana bitta CuO ikkilik birikmasida aniqlaymiz. Mis ikkilamchi kichik guruhda (birinchi guruh) joylashganligi sababli, o'rganilayotgan ko'rsatkich ko'rsatilishi mumkin turli ma'nolar. Shuning uchun uni aniqlash uchun birinchi navbatda kislorod uchun indikatorni aniqlash kerak.
Ikkilik formulaning oxirida joylashgan metall bo'lmaganlar uchun oksidlanish darajasi manfiy qiymatga ega. Ushbu element oltinchi guruhda joylashganligi sababli, sakkizdan oltitani ayirishda kislorodning oksidlanish darajasi -2 ga to'g'ri kelishini olamiz. Murakkabda indekslar yo'qligi sababli, misning oksidlanish darajasi ijobiy bo'ladi, +2 ga teng.
Kimyoviy jadval yana qanday ishlatiladi? Uch elementdan iborat formulalardagi elementlarning oksidlanish darajalari ham ma'lum bir algoritm bo'yicha hisoblanadi. Birinchidan, bu ko'rsatkichlar birinchi va oxirgi elementga joylashtiriladi. Birinchisi uchun bu ko'rsatkich ijobiy qiymatga ega bo'ladi, valentlikka mos keladi. Metall bo'lmagan ekstremal element uchun bu ko'rsatkich salbiy qiymatga ega, u farq sifatida aniqlanadi (guruh raqami sakkizdan chiqariladi). Markaziy elementning oksidlanish darajasini hisoblashda matematik tenglama qo'llaniladi. Hisob-kitoblar har bir element uchun mavjud indekslarni hisobga oladi. Barcha oksidlanish darajalarining yig'indisi nolga teng bo'lishi kerak.
Sulfat kislotada aniqlashga misol
Bu birikmaning formulasi H 2 SO 4 dir. Vodorodning oksidlanish darajasi +1, kislorod -2 ga teng. Oltingugurtning oksidlanish darajasini aniqlash uchun matematik tenglama tuzamiz: + 1 * 2 + X + 4 * (-2) = 0. Oltingugurtning oksidlanish darajasi +6 ga mos kelishini olamiz.
Xulosa
Qoidalardan foydalanganda siz redoks reaktsiyalarida koeffitsientlarni tartibga solishingiz mumkin. Bu masala maktab o‘quv dasturining 9-sinfi kimyo kursida ko‘rib chiqiladi. Bundan tashqari, oksidlanish darajalari haqidagi ma'lumotlar OGE va Yagona davlat imtihonining vazifalarini bajarishga imkon beradi.
Oksidlanish darajasi. Element atomining oksidlanish darajasini birikmaning kimyoviy formulasi bo'yicha aniqlash. Elementlar atomlarining ma'lum oksidlanish darajalariga ko'ra birikma formulasini tuzish
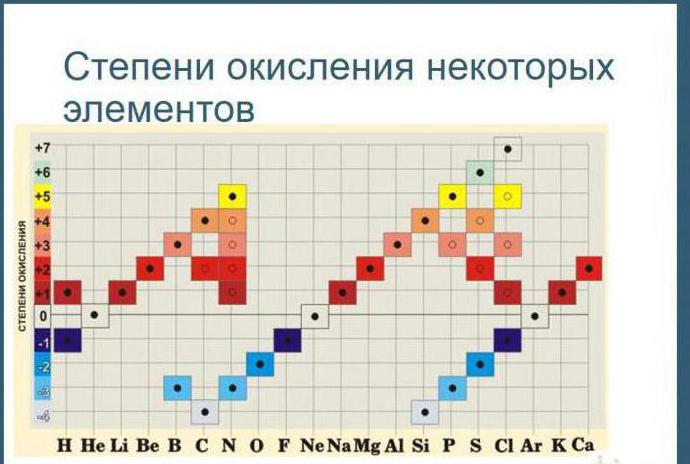
Elementning oksidlanish darajasi moddadagi atomning shartli zaryadidir, u ionlardan iborat degan faraz bilan hisoblanadi. Elementlarning oksidlanish darajasini aniqlash uchun ba'zi qoidalarni yodda tutish kerak:
1. Oksidlanish darajasi musbat, manfiy yoki nolga teng bo'lishi mumkin. Belgilangan Arab raqami element belgisi ustidagi ortiqcha yoki minus belgisi bilan.
2. Oksidlanish darajalarini aniqlashda ular moddaning elektron manfiyligidan kelib chiqadi: birikmadagi barcha atomlarning oksidlanish darajalari yig'indisi nolga teng.
3. Agar birikma bir element atomlari tomonidan (oddiy moddada) hosil bo'lsa, u holda bu atomlarning oksidlanish darajasi nolga teng.
4. Ba'zi kimyoviy elementlarning atomlariga odatda po'latga oksidlanish darajalari beriladi. Masalan, birikmalardagi ftorning oksidlanish darajasi doimo -1 ga teng; litiy, natriy, kaliy, rubidiy va seziy +1; magniy, kaltsiy, stronsiy, bariy va sink +2, alyuminiy +3.
5. Vodorodning oksidlanish darajasi ko'pchilik birikmalarda +1, faqat ba'zi metallar bilan birikmalarda -1 ga teng (KH, BaH 2).
6. Aksariyat birikmalarda kislorodning oksidlanish darajasi -2 ga teng, faqat ayrim birikmalarda -1 (H 2 O 2, Na 2 O 2 yoki +2 (OF 2)) oksidlanish darajasi beriladi.
7. Ko'pgina kimyoviy elementlarning atomlari o'zgaruvchan oksidlanish darajasini ko'rsatadi.
8. Metall atomining birikmalardagi oksidlanish darajasi musbat va son jihatdan uning valentligiga teng.
9. Elementning maksimal musbat oksidlanish darajasi odatda element joylashgan davriy tizimdagi guruh raqamiga teng.
10. Metalllarning minimal oksidlanish darajasi nolga teng. Metall bo'lmaganlar uchun, ko'p hollarda, pastki salbiy oksidlanish darajasi guruh raqami va sakkizinchi raqam o'rtasidagi farqga teng.
11. Atomning oksidlanish darajasi oddiy ionni (bir atomdan iborat) hosil qiladi, bu ionning zaryadiga teng.
Yuqoridagi qoidalardan foydalanib, H 2 SO 4 tarkibidagi kimyoviy elementlarning oksidlanish darajalarini aniqlaymiz. Bu uchta kimyoviy element - vodorod H, oltingugurt S va kislorod O dan iborat murakkab moddadir. Biz ular uchun doimiy bo'lgan elementlarning oksidlanish darajalariga e'tibor qaratamiz. Bizning holatda, bu vodorod H va kislorod O:.
Oltingugurtning noma’lum oksidlanish darajasini aniqlaymiz. Bu birikmadagi oltingugurtning oksidlanish darajasi x: bo'lsin.
Har bir element uchun uning indeksini oksidlanish darajasiga ko'paytirish orqali tenglamalar tuzamiz va olingan miqdorni nolga tenglashtiramiz: 2 (+1) + x + 4 (-2) = 0
Shuning uchun oltingugurtning oksidlanish darajasi plyus olti :.
Quyidagi misolda biz birikma formulani qanday yozishni bilib olamiz ma'lum darajalar element atomlarining oksidlanishi. Temir (III) oksidning formulasini tuzamiz. "Oksid" so'zi temir belgisining o'ng tomonida kislorod belgisi yozilishi kerakligini anglatadi: FeO.
Kimyoviy elementlarning ramzlari ustidagi oksidlanish darajalariga e'tibor bering. Temirning oksidlanish darajasi qavs ichida (III) nomida ko'rsatilgan, shuning uchun u +3 ga teng, oksidlardagi kislorodning oksidlanish darajasi -2:.
3 va 2 raqamlari uchun eng kichik umumiy ko'paytmani topamiz, bu 6. 6 raqamini 3 ga bo'ling, biz 2 raqamini olamiz - bu temir uchun indeks. 6 raqamini 2 ga bo'ling, biz 3 raqamini olamiz - bu kislorod uchun indeks:.
Quyidagi misolda element atomlari va ion zaryadlarining oksidlanish darajalari ma'lum bo'lgan birikma formulasini qanday shakllantirishni bilib olaylik. Kalsiy ortofosfat formulasini tuzamiz. "Ortofosfat" so'zi Kaltsiy belgisining o'ng tomonida ortofosfat kislotaning kislota qoldig'i yozilishi kerakligini anglatadi: CaPO 4.
Kaltsiyning oksidlanish holatiga (to'rtinchi qoida) va kislota qoldig'ining zaryadiga e'tibor bering (eruvchanlik jadvali bo'yicha):
Keling, 2 va 3 raqamlari uchun eng kichik umumiy ko'paytmani topamiz, bu 6. 6 raqamini 2 ga bo'ling, biz 3 raqamini olamiz - bu kaltsiy uchun indeks. 6 raqamini 3 ga bo'ling, biz 2 raqamini olamiz - bu kislota qoldig'i indeksi :.
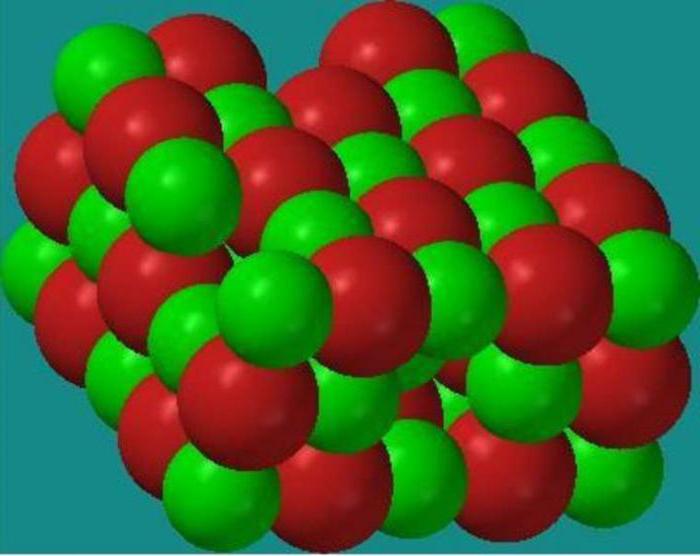
Kristal panjaralar
Kristal panjaralar. Atom, molekulyar va ion kristallari. Moddalarning fizik xossalarining kristall panjaralar turlariga bog'liqligi
Kristalli moddalarda atomlar, molekulalar va ionlar ma'lum masofalarda tartibli joylashgan. Kristallardagi zarrachalarning bunday muntazam joylashishi kristall panjara deb ataladi. Ushbu panjara tugunlarida qaysi zarrachalar joylashganligiga qarab ion, atom va molekulyar kristall panjaralar farqlanadi. Metall kristall panjaralar ham ma'lum.
Ion kristalli panjaralar kimyoviy bog'lanishning ion turiga ega bo'lgan birikmalarga xosdir. Bunday panjaralarning joylarida qarama-qarshi zaryadlangan ionlar joylashgan. Ionlararo o'zaro ta'sir kuchlari juda katta, shuning uchun bunday turdagi kristall panjarali moddalar uchuvchan emas, qattiq, o'tga chidamli, ularning eritmalari va eritmalari elektr tokini o'tkazadi. Oddiy vakillar bunday birikmalar tuzlar, masalan, natriy xlorid, kaliy nitrat va boshqalar.
Atom kristall panjaralari kimyoviy bog'lanishning kovalent turiga ega bo'lgan birikmalarga xosdir. Bunday panjaralarning joylarida kovalent bog'lar bilan bog'langan alohida atomlar mavjud. Barcha bog'lanishlar teng va kuchli, shuning uchun bunday turdagi kristall panjarali moddalar yuqori qattiqlik bilan ajralib turadi, yuqori haroratlar erish, kimyoviy inertlik. Ushbu turdagi kristall panjara olmos, kremniy (IV) oksidi, bor uchun xosdir.
Molekulyar kristall panjaralar kimyoviy bog'lanishning kovalent turiga ega bo'lgan birikmalarga xosdir. Bunday panjaralarning joylari qutbsiz yoki qutbli molekulalarni o'z ichiga oladi. O'zaro ta'sir kuchlari zaif bo'lganligi sababli, bunday turdagi kristall panjarali moddalar past qattiqlik, past erish va qaynash nuqtalariga ega va uchuvchanlik bilan tavsiflanadi. Bu turdagi kristall panjara kislorod, yod, suv, glyukoza, spirtlar, naftalin uchun xosdir.
Shunday qilib, kristall panjaraning turi va o'rtasida ma'lum bir munosabat mavjud jismoniy xususiyatlar moddalar. Demak, moddaning tuzilishi ma’lum bo’lsa, uning xossalarini oldindan aytish mumkin, aksincha, moddaning xossalari ma’lum bo’lsa, tuzilishini aniqlash mumkin.
Kovalent bog'lanish, uning turlari - qutbli va qutbsiz
Kovalent bog'lanish, uning turlari - qutbli va qutbsiz. Kovalent qutbsiz bog'lanish hosil bo'lishi. Kovalent qutbli bog'lanishning hosil bo'lishi. Moddalar molekulalarining elektron formulalari
kovalent bog'lanish elektron juftlarini almashish natijasida hosil bo'lgan kimyoviy bog'lanishdir.
Keling, H 2 vodorod molekulasi misolida kovalent bog'lanishning hosil bo'lish mexanizmini ko'rib chiqaylik. Vodorod atomlari elektron formulaga ega: 1 H 1s 1.
Ikki vodorod atomi bir-biriga yaqinlashganda, antiparallel spinli ikkita elektron (elektronlar turli yo'nalishdagi o'qlar bilan belgilanadi) umumiy (umumiy) elektron juftligini hosil qilish bilan o'zaro ta'sir qiladi.
Kovalent bog'lanishning hosil bo'lish sxemasini tashqi darajadagi juftlanmagan elektronni bitta nuqta bilan va umumiy elektron juftini ikkita nuqta bilan belgilash orqali ifodalash mumkin. Umumiy elektron juftlik, ya'ni. kovalent bog'lanish, ko'pincha chiziq bilan belgilanadi. Vodorod atomlarining s-orbitallarining ustma-ust tushishi natijasida umumiy elektron juftligi hosil bo'ladi, orbitallarning bir-biriga yopishgan qismida esa orbital elektron zichligi hosil bo'ladi.
Xlor Cl2 molekulasida kovalent bog'lanish hosil bo'lishini ko'rib chiqaylik. Xlor atomlari elektron formulaga ega: 17 Cl 1s 2 2s 2 2p 6 3s 2 3p 5.
Xlor atomining tashqi energetik sathida yettita elektron, 3p pastki sathlarida bitta juftlashtirilmagan elektron mavjud. Ikki xlor atomi birlashganda 3p orbitallar juftlanmagan elektronlar bilan ustma-ust tushadi va umumiy elektron juft hosil bo'ladi. Cl 2 molekulasidagi har bir xlor atomi uchta bo'linmagan elektron juftlarini (bir atomga tegishli) saqlaydi.
H2 vodorod molekulasida xlor molekulasi Cl 2 kabi oddiy (yagona) bog' hosil bo'ladi. Ikki atom o'rtasida ikkita yoki uchta elektron juftlik paydo bo'ladigan molekulalar mavjud. Bunday kovalent bog'lanishlar mos ravishda ikki yoki uchlik deb ataladi. Ikki va uch tomonlama obligatsiyalarning umumiy nomi ko'p obligatsiyalardir.
Masalan, O 2 kislorod molekulasida kovalent bog lanish hosil bo lishini ko rib chiqaylik. Kislorod atomlari elektron formulaga ega: 8 O 1s 2 2s 2 2p 4 .
Kislorod atomining tashqi energiya darajasida oltita elektron, 2p pastki sathlarida ikkita juftlashtirilmagan elektron mavjud. O 2 molekulasida kimyoviy bog'lanish hosil bo'lishida har bir kislorod atomining ikkita elektroni ishtirok etadi. IN bu holat ikkita umumiy elektron juft (qo'sh bog') hosil bo'ladi. O 2 molekulasidagi har bir kislorod atomi ikkita taqsimlanmagan elektron juftini saqlaydi.
Vodorod molekulasida kovalent bog'lanish hosil bo'lganda, vodorod atomlarining har biri umumiy elektron juft hosil bo'lishi sababli barqaror ikki elektronli konfiguratsiyadir. Boshqa hollarda, kovalent bog'lanish hosil bo'lganda, masalan, xlor va kislorod molekulalarida, atomlarning har biri sakkiz elektrondan iborat barqaror konfiguratsiyadir.
Ko'rib chiqilgan uchta molekula (vodorod, xlor va kislorod) holatida bir xil elektron manfiylikka ega bo'lgan atomlar o'rtasida kovalent bog'lanish hosil bo'ldi. Bunday o'zaro ta'sir molekulalari ikkita bir xil atomdan iborat oddiy metall bo'lmagan moddalar hosil bo'lganda kuzatiladi. Bunda umumiy elektron juftlar atomlar yadrolari orasida nosimmetrik joylashadi, ular bog`lanadi. Natijada, musbat va manfiy zaryad markazlari bir-biriga to'g'ri keladigan molekulalar hosil bo'ladi.
Demak, umumiy elektron juftlari hisobiga bir xil elektron manfiylikka ega boʻlgan atomlar oʻrtasida hosil boʻladigan kovalent bogʻlanish kovalent qutbsiz bogʻlanish deyiladi. Shuni esda tutish kerakki, ushbu turdagi kimyoviy bog'lanish oddiy metall bo'lmagan moddalarda hosil bo'ladi. Kovalent qutbsiz bog'lanish turiga ega bo'lgan moddalarga misol sifatida ftor F 2, brom Br 2, yod I 2, azot N 2 ni nomlash mumkin.
Agar o'zaro ta'sir qiluvchi atomlar turli xil elektromanfiylikka ega bo'lsa (turli xil kimyoviy elementlarning atomlari), u holda umumiy elektronlar juftligi kattaroq elektronegativlikka ega bo'lgan atom tomon siljiydi. Bunda elektromanfiyligi yuqori bo'lgan atomda qisman manfiy zaryad, elektronmanfiyligi past bo'lgan atomda qisman musbat zaryad hosil bo'ladi. Ushbu qisman to'lovlar mutlaq qiymatdagi birlikdan kamroq.
Masalan, vodorod xlorid molekulasi HCl hosil bo'lganda, vodorod atomining s-orbitali va xlor atomining p-orbitali bir-biriga yopishadi. Umumiy elektron juftligi o'zaro ta'sir qiluvchi atomlarning markazlariga nisbatan assimetrik joylashgan. U ko'proq elektromanfiy xlorga o'tadi. Xlor atomi qisman manfiy zaryadga, vodorod atomi esa qisman musbat zaryadga ega. Bunda molekuladagi musbat va manfiy zaryadlarning markazlari bir-biriga mos kelmaydi. Bunday molekulalar qutblar yoki dipollar deb ataladi. Dipol - kattaligi bir xil, ammo ishorasi qarama-qarshi bo'lgan ikkita zaryaddan iborat tizim.
Demak, elektron manfiyligi biroz farq qiladigan atomlar oʻrtasida hosil boʻladigan kovalent bogʻlanish kovalent qutbli bogʻlanish deyiladi. Shuni esda tutish kerakki, bu turdagi kimyoviy bog'lanish metall bo'lmagan atomlar tomonidan hosil qilingan murakkab moddalarda hosil bo'ladi. Kovalent qutbli bog'lanish turiga ega bo'lgan moddalarga misol sifatida ftor vodorod HF, suv H 2 O, ammiak NH 3, metan CH 4, uglerod (IV) oksidi CO 2 ni nomlash mumkin.
Ion bog'lanish bir yoki bir nechta elektronlarning bir atomdan ikkinchisiga to'liq o'tishi natijasida hosil bo'ladi. Ushbu turdagi bog'lanish faqat elektron manfiyligi sezilarli darajada farq qiladigan elementlarning atomlari o'rtasida mumkin. Bunda elektron kichik elektron manfiy atomdan yuqori elektron manfiy atomga o'tadi. Shuni esda tutish kerakki, ushbu turdagi kimyoviy bog'lanish metallar va metall bo'lmaganlar atomlari o'rtasida hosil bo'ladi. Masalan, asosiy kichik guruhlarning birinchi va ikkinchi guruhlari elementlari davriy tizim(tipik metallar) to'g'ridan-to'g'ri davriy tizimning asosiy kichik guruhlari oltinchi va ettinchi guruhlari elementlari bilan birlashtiriladi (odatiy metall bo'lmaganlar).
Kaliy xlorid tarkibida ion bog'lanish hosil bo'lish mexanizmini ko'rib chiqamiz. Kaliy atomida bitta valentlik elektron mavjud (kaliy joylashgan guruh soni bilan aniqlanadi). Xlor atomida ettita valentlik elektron mavjud (xlor joylashgan guruh soni bilan aniqlanadi). Kaliy atomlari xlor atomlari bilan o'zaro ta'sirlashganda, kaliy atomining valent elektroni to'liq xlor atomining tashqi darajasiga o'tadi va uni sakkiz elektronli tuzilishda yakunlaydi. Bunda kaliy atomi elektronni yo'qotib, +1 musbat zaryad oladi va K + kationiga aylanadi, xlor atomi esa elektron qo'shib, manfiy zaryadga -1 ega bo'ladi va Cl - anioniga aylanadi. Elektrostatik kuchlar ta'sirida qarama-qarshi zaryadlangan ionlar tortiladi va kaliy xlorid birikmasi hosil bo'ladi. Ushbu jarayonni diagramma bilan ifodalash mumkin:
Oddiy sharoitda faqat ba'zi kimyoviy elementlar (noble gazlar) monoatomik gaz holatida bo'ladi. Boshqa elementlarning atomlari, aksincha, alohida mavjud emas, balki atomlar birikmasidan hosil bo'lgan molekulalar yoki kristall panjaralarning bir qismidir. Demak, atomlarning bir-biri bilan bog'lanishining sababi bor. Buning sababi kimyoviy bog'lanishdir, chunki atomlar o'rtasida atomlarni bir-biriga tuta oladigan ma'lum elektrostatik kuchlar mavjud. Atomlar o'rtasida kimyoviy bog'lanish hosil bo'lishi isbotlangan Asosiy rol valent elektronlarga (yadro bilan zaif bog'langan tashqi darajadagi elektronlar) tegishli.
Kimyoviy bog'lanish nazariyasiga ko'ra, ikki yoki sakkiz elektrondan iborat tashqi qobiqlar eng katta kuchga ega. Asil gazlar shunday elektron qobiqlarga ega. Oddiy sharoitlarda asil gazlarning boshqa elementlar bilan kimyoviy reaksiyaga kirishmasligining sababi ham shu. Tashqi sathida sakkiz (yoki ikkita) dan kam elektronga ega atomlar olijanob gaz tuzilmalarini olishga harakat qiladilar. Shuning uchun kimyoviy reaksiya jarayonida molekula hosil bo'lganda, atomlar barqaror sakkiz elektronli yoki ikki elektronli qobiqni olishga harakat qiladilar.
Barqaror elektron konfiguratsiyaning shakllanishi bir necha yo'llar bilan sodir bo'lishi mumkin va turli tuzilmalarning molekulalari yoki molekulyar bo'lmagan birikmalarining shakllanishiga olib keladi. Natijada kimyoviy bog'lanishlarning kovalent va ionli turlari farqlanadi. Ushbu turlarga qo'shimcha ravishda kimyoviy bog'lanishlarning boshqa turlari mavjud: metall va vodorod (molekulyar).
Atomning birikmalardagi rasmiy zaryadi yordamchi miqdor bo'lib, u odatda kimyoda elementlarning xususiyatlarini tavsiflashda qo'llaniladi. Bu shartli elektr zaryadi oksidlanish darajasidir. Uning qiymati ko'plab kimyoviy jarayonlar natijasida o'zgaradi. Zaryad rasmiy bo'lsa-da, u oksidlanish-qaytarilish reaktsiyalarida (ORD) atomlarning xossalari va xatti-harakatlarini yorqin ifodalaydi.
Oksidlanish va qaytarilish
Ilgari kimyogarlar kislorodning boshqa elementlar bilan oʻzaro taʼsirini tasvirlash uchun “oksidlanish” atamasidan foydalanganlar. Reaksiyalarning nomi kislorodning lotincha nomi - Oxygenium dan keladi. Keyinchalik ma'lum bo'ldiki, boshqa elementlar ham oksidlanadi. Bunday holda, ular tiklanadi - ular elektronlarni biriktiradilar. Har bir atom molekula hosil bo'lishi paytida uning valentlik elektron qobig'ining tuzilishini o'zgartiradi. Bunday holda, rasmiy zaryad paydo bo'ladi, uning qiymati shartli ravishda berilgan yoki qabul qilingan elektronlar soniga bog'liq. Ushbu qiymatni tavsiflash uchun ilgari ingliz kimyoviy atamasi "oksidlanish raqami" ishlatilgan, bu tarjimada "oksidlanish soni" degan ma'noni anglatadi. Uni qo'llashda ular molekulalar yoki ionlardagi bog'lovchi elektronlar ko'proq bo'lgan atomga tegishli degan taxmindan kelib chiqadilar. yuqori qiymat elektronegativlik (EO). O'z elektronlarini ushlab turish va ularni boshqa atomlardan tortib olish qobiliyati kuchli metall bo'lmaganlarda (galogenlar, kislorod) yaxshi ifodalangan. Kuchli metallar (natriy, kaliy, litiy, kaltsiy, boshqa gidroksidi va ishqoriy tuproq elementlari) qarama-qarshi xususiyatlarga ega.
Oksidlanish darajasini aniqlash
Oksidlanish darajasi, agar bog'lanishning hosil bo'lishida ishtirok etuvchi elektronlar to'liq elektron manfiy elementga siljigan bo'lsa, atom ega bo'ladigan zaryaddir. Molekulyar tuzilishga ega bo'lmagan moddalar mavjud (ishqoriy metall galogenidlari va boshqa birikmalar). Bunday hollarda oksidlanish darajasi ionning zaryadiga to'g'ri keladi. Shartli yoki real zaryad atomlar hozirgi holatga kelishidan oldin qanday jarayon sodir bo'lganligini ko'rsatadi. Musbat oksidlanish darajasi - atomlardan chiqarilgan elektronlarning umumiy soni. Salbiy ma'no oksidlanish darajasi olingan elektronlar soniga teng. Kimyoviy elementning oksidlanish darajasini o'zgartirib, reaktsiya paytida uning atomlari bilan nima sodir bo'lishini (va aksincha) hukm qiladi. Moddaning rangi oksidlanish holatida qanday o'zgarishlar sodir bo'lganligini aniqlaydi. Xrom, temir va boshqa bir qator elementlarning birikmalari turli xil valentlikni namoyon qiladi.
Oksidlanish darajasining salbiy, nol va musbat qiymatlari

Oddiy moddalar hosil bo'ladi kimyoviy elementlar Bilan bir xil qiymat EO. Bunday holda, bog'lovchi elektronlar barcha strukturaviy zarrachalarga teng ravishda tegishlidir. Shuning uchun oddiy moddalarda oksidlanish darajasi (H 0 2, O 0 2, C 0) elementlarga xos emas. Atomlar elektronlarni qabul qilganda yoki umumiy bulut o'z yo'nalishi bo'yicha siljiganida, minus belgisi bilan zaryadlarni yozish odatiy holdir. Masalan, F -1, O -2, C -4. Elektronlarni berish orqali atomlar haqiqiy yoki rasmiy musbat zaryad oladi. OF 2 oksidida kislorod atomi ikkita ftor atomiga bittadan elektron beradi va O +2 oksidlanish holatida bo'ladi. Molekula yoki ko'p atomli ionda ko'proq elektronegativ atomlar barcha bog'lovchi elektronlarni oladi, deb ishoniladi.
Oltingugurt turli valentlik va oksidlanish darajasini ko'rsatadigan elementdir.
Asosiy kichik guruhlarning kimyoviy elementlari ko'pincha VIII ga teng past valentlikni namoyon qiladi. Masalan, vodorod sulfid va metall sulfidlardagi oltingugurtning valentligi II ga teng. Element qo'zg'aluvchan holatda oraliq va undan yuqori valentliklar bilan xarakterlanadi, atom bir, ikki, to'rt yoki barcha olti elektrondan voz kechib, mos ravishda I, II, IV, VI valentliklarni namoyon qiladi. Xuddi shu qiymatlar, faqat minus yoki ortiqcha belgisi bilan, oltingugurtning oksidlanish darajalariga ega:
- ftor sulfidida bitta elektron beradi: -1;
- vodorod sulfidida eng past qiymat: -2;
- dioksid oraliq holatida: +4;
- trioksid, sulfat kislota va sulfatlarda: +6.
Eng yuqori oksidlanish holatida oltingugurt faqat elektronlarni qabul qiladi, eng past holatda u kuchli qaytaruvchi xususiyatga ega. S+4 atomlari sharoitga qarab birikmalarda qaytaruvchi yoki oksidlovchi moddalar vazifasini bajarishi mumkin.
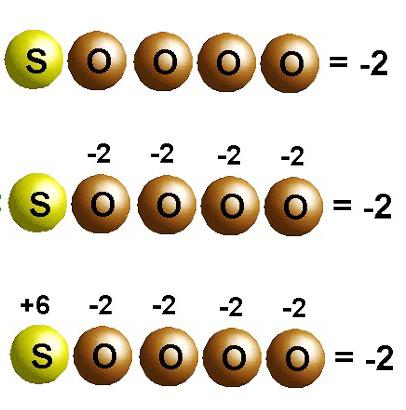
Kimyoviy reaksiyalarda elektronlarning uzatilishi
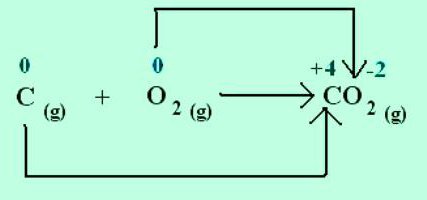
Natriy xlorid kristalining hosil bo'lishida natriy elektronlarni ko'proq elektromanfiy xlorga beradi. Elementlarning oksidlanish darajalari ionlarning zaryadlari bilan mos keladi: Na +1 Cl -1 . Elektron juftlarining sotsializatsiyasi va ko'proq elektronegativ atomga siljishi natijasida hosil bo'lgan molekulalar uchun faqat rasmiy zaryad tushunchasi qo'llaniladi. Ammo barcha birikmalar ionlardan tashkil topgan deb taxmin qilish mumkin. Keyin atomlar elektronlarni jalb qilish orqali shartli manfiy zaryadga ega bo'ladilar va berish orqali ular musbat zaryadga ega bo'ladilar. Reaktsiyalarda qancha elektron almashganligini ko'rsating. Masalan, karbonat angidrid molekulasida C +4 O - 2 2, uglerod uchun kimyoviy belgining yuqori o'ng burchagida ko'rsatilgan indeks atomdan chiqarilgan elektronlar sonini ko'rsatadi. Bu moddadagi kislorod -2 oksidlanish darajasiga ega. O kimyoviy belgisi bilan mos keladigan indeks atomga qo'shilgan elektronlar sonidir.
Oksidlanish darajasini qanday hisoblash mumkin
Atomlar tomonidan berilgan va qo'shilgan elektronlar sonini hisoblash ko'p vaqt talab qilishi mumkin. Quyidagi qoidalar bu vazifani osonlashtiradi:
- Oddiy moddalarda oksidlanish darajalari nolga teng.
- Neytral moddadagi barcha atomlar yoki ionlarning oksidlanish yig'indisi nolga teng.
- Murakkab ionda barcha elementlarning oksidlanish darajalari yig'indisi butun zarrachaning zaryadiga mos kelishi kerak.
- Elektromanfiyroq atom salbiy oksidlanish holatiga ega bo'lib, u minus belgisi bilan yoziladi.
- Kamroq elektronegativ elementlar ijobiy oksidlanish darajasini oladi, ular ortiqcha belgisi bilan yoziladi.
- Kislorod odatda -2 oksidlanish darajasini ko'rsatadi.
- Vodorod uchun xarakterli qiymat: +1, metall gidridlarda topilgan: H-1.
- Ftor barcha elementlarning eng elektronegatividir, uning oksidlanish darajasi har doim -4 ni tashkil qiladi.
- Aksariyat metallar uchun oksidlanish raqamlari va valentliklari bir xil.

Oksidlanish holati va valentlik
Ko'pgina birikmalar oksidlanish-qaytarilish jarayonlari natijasida hosil bo'ladi. Elektronlarning bir elementdan ikkinchisiga o'tishi yoki siljishi ularning oksidlanish darajasi va valentligining o'zgarishiga olib keladi. Ko'pincha bu qiymatlar mos keladi. "Oksidlanish darajasi" atamasining sinonimi sifatida "elektrokimyoviy valentlik" iborasini ishlatish mumkin. Ammo istisnolar mavjud, masalan, ammoniy ionida azot tetravalentdir. Shu bilan birga, bu elementning atomi -3 oksidlanish darajasida. Organik moddalarda uglerod har doim tetravalent bo'ladi, lekin metan CH 4, chumoli spirti CH 3 OH va HCOOH kislotasidagi C atomining oksidlanish darajalari turli qiymatlarga ega: -4, -2 va +2.
Oksidlanish-qaytarilish reaksiyalari

Ko'p redoks tanqidiy jarayonlar sanoat, texnologiya, yashash va jonsiz tabiat: yonish, korroziya, fermentatsiya, hujayra ichidagi nafas olish, fotosintez va boshqa hodisalar.
OVR tenglamalarini tuzishda koeffitsientlar elektron balans usuli yordamida tanlanadi, unda quyidagi toifalar ishlaydi:
- oksidlanish darajasi;
- qaytaruvchi vosita elektronlarni beradi va oksidlanadi;
- oksidlovchi vosita elektronlarni qabul qiladi va kamayadi;
- berilgan elektronlar soni biriktirilganlar soniga teng bo'lishi kerak.
Atomning elektronlarni olishi uning oksidlanish darajasining pasayishiga (qaytarilishi) olib keladi. Atom tomonidan bir yoki bir nechta elektronni yo'qotish reaktsiyalar natijasida elementning oksidlanish sonining ortishi bilan birga keladi. OVR uchun suvli eritmalardagi kuchli elektrolitlar ionlari orasidan oqadigan elektron balans emas, balki yarim reaksiyalar usuli ko'proq qo'llaniladi.
O'qish foydali bo'lishi mumkin:
- chet elda davolanish. Qo'rqmang. Chet elda davolanish - tibbiy turizmning asosiy yo'nalishlari Xorijda davolanish qayerda yaxshiroq;
- Menda savol bor: stressdan qanday qutulish kerak;
- Romina Power Albano Carrisi bolalar hayotidagi asosiy fojialar, ular nima qilishlari;
- Agar bola bolalar bog'chasida do'st bo'lishni istamasa, nima qilish kerak;
- Koriander - foydali xususiyatlari va qo'llanilishi Kosmetologiyada Coriander efir moyi;
- Tuzlangan karam bilan klassik vinaigrette - fotosurat bilan bosqichma-bosqich retsept;
- Sog'lom tanada sog'lom aql?;
- Pensionerni ishdan bo'shatish tartibi: mavjud asoslar va cheklovlar va o'z huquqlaringizni qanday himoya qilishingiz mumkin?;