نحوه محاسبه کمترین حالت اکسیداسیون درجه اکسیداسیون چقدر است؟ چگونه می توان وضعیت اکسیداسیون عناصر را تعیین کرد؟
چنین موردی برنامه آموزشی مدرسهاز آنجایی که شیمی مشکلات متعددی را برای اکثر دانشآموزان مدرن ایجاد میکند، تعداد کمی میتوانند درجه اکسیداسیون ترکیبات را تعیین کنند. بزرگترین مشکلات برای دانش آموزان مدرسه ای است که شیمی معدنی می خوانند، یعنی دانش آموزان مدرسه ابتدایی (کلاس های 8-9). سوء تفاهم از موضوع منجر به بروز خصومت در بین دانش آموزان با این موضوع می شود.
معلمان تعدادی از دلایل را برای چنین "بیزاری" دانش آموزان راهنمایی و دبیرستان از شیمی شناسایی می کنند: عدم تمایل به درک اصطلاحات پیچیده شیمیایی، ناتوانی در استفاده از الگوریتم ها برای در نظر گرفتن یک فرآیند خاص، مشکلات دانش ریاضی. وزارت آموزش و پرورش فدراسیون روسیه تغییرات جدی در محتوای موضوع ایجاد کرده است. علاوه بر این، تعداد ساعات تدریس شیمی «کاهش» شد. این تأثیر منفی بر کیفیت دانش در موضوع، کاهش علاقه به مطالعه این رشته داشت.
چه مباحثی از درس شیمی برای دانش آموزان مدرسه ای سخت ترین است؟
توسط برنامه جدیددوره رشته تحصیلی "شیمی" مدرسه پایه شامل چندین موضوع جدی است: جدول تناوبی عناصر D.I. مندلیف، کلاس های مواد معدنی، تبادل یونی. سخت ترین کار برای کلاس هشتم تعریف اکسید است.
قوانین قرار دادن
قبل از هر چیز دانش آموزان باید بدانند که اکسیدها ترکیبات پیچیده دو عنصری هستند که شامل اکسیژن هستند. یک پیش نیازتعلق یک ترکیب دوتایی به کلاس اکسیدها، دومین محل اکسیژن در این ترکیب است.
الگوریتم اکسیدهای اسیدی
برای شروع، توجه می کنیم که حالت های اکسیداسیون عبارت های عددی ظرفیت عناصر هستند. توسط غیر فلزات یا فلزات با ظرفیت 4 تا 7 تشکیل شده است، دومین مورد در چنین اکسیدهایی لزوماً اکسیژن است.
در اکسیدها، ظرفیت اکسیژن همیشه با دو برابر است؛ می توان آن را از جدول تناوبی عناصر D.I. Mendeleev تعیین کرد. چنین غیر فلزی معمولی مانند اکسیژن، که در گروه ششم از زیر گروه اصلی جدول تناوبی قرار دارد، برای تکمیل سطح انرژی خارجی خود، دو الکترون را می پذیرد. غیر فلزات در ترکیبات دارای اکسیژن اغلب ظرفیت بالاتری را نشان می دهند که با تعداد خود گروه مطابقت دارد. یادآوری این نکته مهم است که وضعیت اکسیداسیون عناصر شیمیایی شاخصی است که بر عدد مثبت (منفی) دلالت دارد.
غیر فلزی در ابتدای فرمول حالت اکسیداسیون مثبت دارد. اکسیژن غیر فلزی در اکسیدها پایدار است، شاخص آن -2 است. برای بررسی قابلیت اطمینان ترتیب مقادیر در اکسیدهای اسیدی، باید تمام اعدادی را که تنظیم کرده اید در شاخص های یک عنصر خاص ضرب کنید. اگر مجموع تمام مثبت ها و منفی های درجات تنظیم شده 0 باشد، محاسبات قابل اعتماد در نظر گرفته می شوند.

تدوین فرمول های دو عنصری
حالت اکسیداسیون اتم های عناصر فرصت ایجاد و ثبت ترکیبات از دو عنصر را می دهد. هنگام ایجاد فرمول، برای شروع، هر دو علامت در کنار هم نوشته می شوند، حتماً اکسیژن را در درجه دوم قرار دهید. در بالای هر یک از علائم ثبت شده، مقادیر حالت های اکسیداسیون تجویز می شود، سپس بین اعداد یافت شده عددی وجود دارد که بدون هیچ باقیمانده ای بر هر دو رقم تقسیم می شود. این شاخص باید به طور جداگانه با مقدار عددی درجه اکسیداسیون تقسیم شود و شاخص هایی برای اجزای اول و دوم ماده دو عنصری به دست آید. بالاترین حالت اکسیداسیون از نظر عددی برابر با مقدار بالاترین ظرفیت یک غیر فلز معمولی است، که مشابه عدد گروهی است که در آن غیرفلز در PS قرار دارد.
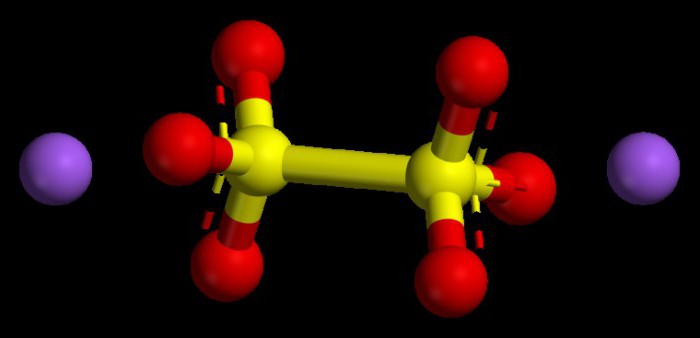
الگوریتم تنظیم مقادیر عددی در اکسیدهای پایه
اکسیدهای فلزات معمولی از این قبیل ترکیبات در نظر گرفته می شوند. آنها در همه ترکیبات دارای شاخص حالت اکسیداسیون بیش از +1 یا +2 نیستند. برای اینکه بفهمید یک فلز در چه وضعیتی قرار دارد، می توانید از جدول تناوبی استفاده کنید. برای فلزات زیر گروه های اصلی گروه اول، این پارامتر همیشه ثابت است، مشابه عدد گروه است، یعنی +1.
فلزات زیر گروه اصلی گروه دوم نیز با حالت اکسیداسیون پایدار، عددی +2 مشخص می شوند. حالتهای اکسیداسیون اکسیدها، با در نظر گرفتن شاخصها (اعداد) آنها باید به صفر برسد، زیرا مولکول شیمیایی یک ذره خنثی و بدون بار در نظر گرفته میشود.
ترتیب حالت های اکسیداسیون در اسیدهای حاوی اکسیژن
اسیدها مواد پیچیده ای هستند که از یک یا چند اتم هیدروژن تشکیل شده اند که با نوعی باقیمانده اسید همراه هستند. با توجه به اینکه حالت های اکسیداسیون اعداد هستند، برای محاسبه آنها به مهارت های ریاضی نیاز است. چنین شاخصی برای هیدروژن (پروتون) در اسیدها همیشه پایدار است، +1 است. بعد، می توانید حالت اکسیداسیون را برای یون اکسیژن منفی مشخص کنید، همچنین پایدار است، -2.
فقط پس از این اقدامات، می توان درجه اکسیداسیون جزء مرکزی فرمول را محاسبه کرد. به عنوان یک نمونه خاص، تعیین حالت اکسیداسیون عناصر در اسید سولفوریک H2SO4 را در نظر بگیرید. با توجه به اینکه مولکول این ماده پیچیده حاوی دو پروتون هیدروژن، 4 اتم اکسیژن است، بیانی به این شکل +2+X-8=0 به دست میآوریم. برای اینکه مجموع آن صفر شود، گوگرد حالت اکسیداسیون 6+ خواهد داشت
ترتیب حالت های اکسیداسیون در نمک ها
نمک ها ترکیبات پیچیده ای هستند که از یون های فلزی و یک یا چند باقی مانده اسید تشکیل شده اند. روشی برای تعیین حالت های اکسیداسیون هر یک از قطعات تشکیل دهندهدر نمک پیچیده مانند اسیدهای حاوی اکسیژن است. با توجه به اینکه حالت اکسیداسیون عناصر یک شاخص عددی است، نشان دادن درست وضعیت اکسیداسیون فلز مهم است.
اگر فلز تشکیل دهنده نمک در زیر گروه اصلی قرار گیرد، حالت اکسیداسیون آن پایدار خواهد بود، مطابق با شماره گروه، یک مقدار مثبت است. اگر نمک حاوی فلزی از یک زیرگروه مشابه از PS باشد، می توان فلزات مختلف را با باقیمانده اسید نشان داد. پس از تنظیم حالت اکسیداسیون فلز، (-2) را قرار دهید، سپس با استفاده از معادله شیمیایی، حالت اکسیداسیون عنصر مرکزی محاسبه می شود.
به عنوان مثال، تعیین حالت اکسیداسیون عناصر در (نمک متوسط) را در نظر بگیرید. NaNO3. نمک توسط فلزی از زیر گروه اصلی گروه 1 تشکیل می شود، بنابراین، حالت اکسیداسیون سدیم +1 خواهد بود. اکسیژن موجود در نیترات ها دارای حالت اکسیداسیون 2- است. برای تعیین مقدار عددی درجه اکسیداسیون معادله +1+X-6=0 است. با حل این معادله، دریافت می کنیم که X باید 5+ باشد، این است

اصطلاحات اساسی در OVR
برای فرآیند اکسیداتیو و همچنین کاهش، اصطلاحات خاصی وجود دارد که دانش آموزان ملزم به یادگیری آن هستند.
حالت اکسیداسیون یک اتم توانایی مستقیم آن برای اتصال الکترون های برخی یون ها یا اتم ها به خود (به دیگران اهدا کردن) است.
اتم های خنثی یا یون های باردار به عنوان یک عامل اکسید کننده در نظر گرفته می شوند. واکنش شیمیاییپذیرش الکترون
عامل احیا کننده اتم های بدون بار یا یون های باردار خواهند بود که در فرآیند برهمکنش شیمیایی الکترون های خود را از دست می دهند.
اکسیداسیون به عنوان روشی برای اهدای الکترون ارائه می شود.
کاهش با پذیرش الکترون های اضافی توسط یک اتم یا یون بدون بار همراه است.
فرآیند ردوکس با واکنشی مشخص می شود که طی آن حالت اکسیداسیون یک اتم لزوماً تغییر می کند. این تعریف به شما امکان می دهد بفهمید که چگونه می توانید تشخیص دهید که واکنش OVR است یا خیر.

قوانین تجزیه OVR
با استفاده از این الگوریتم می توانید ضرایب را در هر واکنش شیمیایی مرتب کنید.
آخرین مرحله ترتیب ضرایب استریوشیمیایی در واکنش مورد بررسی خواهد بود.
مثال OVR
ابتدا باید حالت های اکسیداسیون هر ماده شیمیایی را مرتب کنید. توجه داشته باشید که حالت اکسیداسیون صفر است، زیرا هیچ بازگشتی (ضمیمه) ذرات منفی وجود ندارد. قوانین ترتیب حالت های اکسیداسیون در مواد دوتایی و سه عنصری توسط ما در بالا مورد بحث قرار گرفت.
سپس باید آن اتم ها یا یون هایی را تعیین کنید که در طی تبدیل، حالت های اکسیداسیون تغییر کرده اند.
از سمت چپ معادله نوشته شده، اتم ها یا یون های باردار جدا شده اند که حالت اکسیداسیون خود را تغییر داده اند. این برای ترازنامه ضروری است. در بالای عناصر، مقادیر آنها باید نشان داده شود.
علاوه بر این، آن اتم ها یا یون هایی که در طول واکنش تشکیل شده اند، با علامت +، تعداد الکترون های پذیرفته شده توسط اتم، - تعداد ذرات منفی داده شده، ثبت می شوند. اگر پس از فرآیند برهمکنش، حالت های اکسیداسیون کاهش یابد. این بدان معناست که الکترون ها توسط اتم (یون) پذیرفته شده اند. با افزایش درجه اکسیداسیون، یک اتم (یون) در طول واکنش الکترون می دهد.
کمترین تعداد کلابتدا بر الکترون های دریافتی تقسیم می شود، سپس بر الکترون های داده شده در فرآیند، ضرایب به دست می آید. ارقام یافت شده ضرایب استریوشیمیایی مورد نظر خواهند بود.
عامل اکسید کننده، عامل کاهنده، فرآیندهای رخ داده در طول واکنش را تعیین کنید.
کاربرد عملی این الگوریتم را برای یک واکنش شیمیایی خاص در نظر بگیرید.
Fe+CuSO4=Cu+FeSO4
ما شاخص ها را برای همه مواد ساده و پیچیده محاسبه می کنیم.
از آنجایی که Fe و Cu مواد ساده ای هستند، حالت اکسیداسیون آنها 0 است. در CuSO4، سپس Cu + 2، سپس اکسیژن دارای -2 و گوگرد دارای +6 است. در FeSO4: Fe +2، بنابراین برای O-2، طبق محاسبات S +6.
اکنون ما به دنبال عناصری هستیم که می توانند شاخص ها را تغییر دهند، در شرایط ما آنها Fe و Cu خواهند بود.
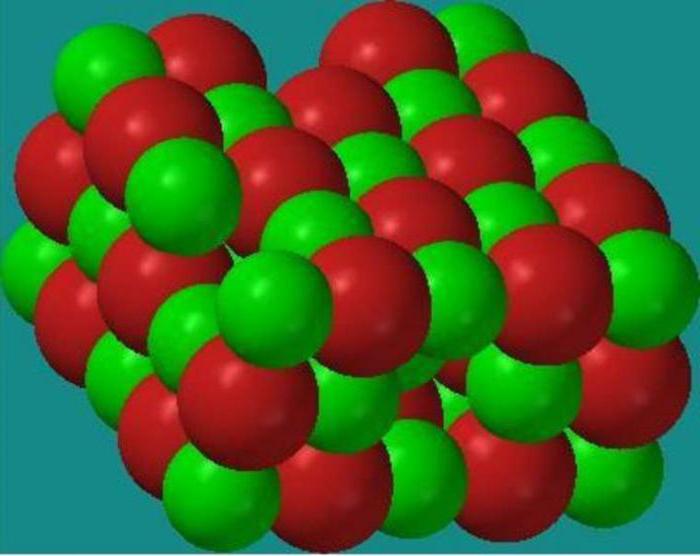
از آنجایی که پس از واکنش، مقدار اتم آهن 2+ شد، 2 الکترون در واکنش تسلیم شد. مس نشانگرهای خود را از +2 به 0 تغییر داده است، بنابراین مس 2 الکترون پذیرفته است. اکنون تعداد الکترون های دریافتی و داده شده توسط اتم آهن و کاتیون مس دو ظرفیتی را تعیین می کنیم. در طول تبدیل، دو الکترون توسط کاتیون مس دو ظرفیتی گرفته شد و همان تعداد الکترون توسط اتم آهن از بین رفت.
در این فرآیند، تعیین حداقل مضرب مشترک معنی ندارد، زیرا تعداد مساوی الکترون در طول تبدیل دریافت می شود و از بین می رود. ضرایب استریوشیمیایی نیز با وحدت مطابقت دارد. در واکنش، آهن در حالی که اکسید می شود، خواص عامل احیا کننده را نشان می دهد. کاتیون مس دو ظرفیتی در واکنشی که دارد به مس خالص کاهش می یابد بالاترین درجهاکسیداسیون

کاربرد فرآیندها
فرمول های حالت اکسیداسیون باید برای هر دانش آموز در کلاس های 8-9 شناخته شود، زیرا این موضوع در آن گنجانده شده است تکالیف OGE. هر فرآیندی که با علائم اکسیداتیو و کاهنده پیش می رود بازی می کند اهمیتدر زندگی ما. بدون آنها، فرآیندهای متابولیک در بدن انسان غیرممکن است.
قسمت اول
1. حالت اکسیداسیون (s. o.) استبار مشروط اتم های یک عنصر شیمیایی در یک ماده پیچیده، بر اساس این فرض محاسبه می شود که از یون های ساده تشکیل شده است.
باید بدونی!
1) در ارتباط با. O. هیدروژن = +1، به جز هیدریدها.
2) در ترکیبات با. O. اکسیژن = -2، به جز پراکسیدها ![]() و فلوراید
و فلوراید
3) حالت اکسیداسیون فلزات همیشه مثبت است.
برای فلزات زیر گروه های اصلی سه گروه اول با. O. ثابت:
فلزات گروه IA - ص. O. = +1،
فلزات گروه IIA - ص. O. = +2،
فلزات گروه IIIA - p. O. = +3.
4) برای اتم های آزاد و مواد ساده ص. O. = 0.
5) کل s. O. همه عناصر موجود در ترکیب = 0.
2. روش تشکیل اسامیترکیبات دو عنصری (دودویی)

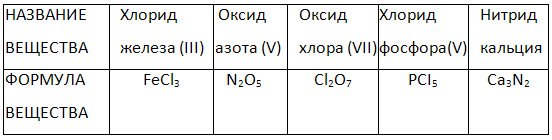
4. جدول «نام و فرمول ترکیبات دوتایی» را کامل کنید.
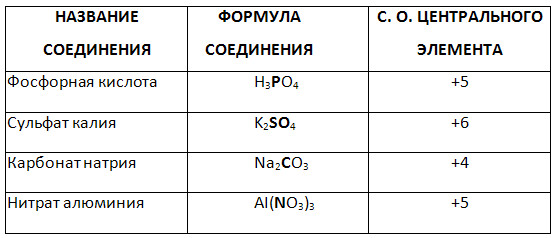
5. درجه اکسیداسیون عنصر برجسته ترکیب پیچیده را تعیین کنید.
قسمت دوم
1. حالت های اکسیداسیون عناصر شیمیایی در ترکیبات را با توجه به فرمول آنها تعیین کنید. نام این مواد را بنویسید.

2. جداسازی مواد FeO، Fe2O3، CaCl2، AlBr3، CuO، K2O، BaCl2، SO3به دو گروه نام مواد را با نشان دادن درجه اکسیداسیون بنویسید.

3. بین نام و حالت اکسیداسیون یک اتم یک عنصر شیمیایی و فرمول ترکیب مطابقت ایجاد کنید.

4. فرمول مواد را با نام بسازید.

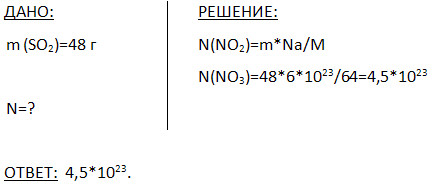
5. در 48 گرم اکسید گوگرد (IV) چند مولکول وجود دارد؟
6. با استفاده از اینترنت و سایر منابع اطلاعاتی، گزارشی در مورد استفاده از هر گونه اتصال باینری طبق طرح زیر تهیه کنید:
1) فرمول؛
2) نام؛
3) خواص؛
4) کاربرد
آب H2O، اکسید هیدروژن.
آب در شرایط عادیمایع، بی رنگ، بی بو، در یک لایه ضخیم - آبی. نقطه جوش حدود 100⁰С است. حلال خوبی است. یک مولکول آب از دو اتم هیدروژن و یک اتم اکسیژن تشکیل شده است، این ترکیب کیفی و کمی آن است. این یک ماده پیچیده است که با موارد زیر مشخص می شود خواص شیمیایی: برهمکنش با فلزات قلیایی، فلزات قلیایی خاکی. واکنش های تبادلی با آب را هیدرولیز می گویند. این واکنش ها دارند پراهمیتدر شیمی
7. حالت اکسیداسیون منگنز در ترکیب K2MnO4:
3) +6
8. کروم کمترین حالت اکسیداسیون را در ترکیبی دارد که فرمول آن عبارت است از:
1) Cr2O3
9. کلر حداکثر حالت اکسیداسیون را در ترکیبی که فرمول آن عبارت است از:
3) Сl2O7
چگونه درجه اکسیداسیون را تعیین کنیم؟ جدول تناوبی به شما این امکان را می دهد که یک مقدار کمی معین را برای هر عنصر شیمیایی ثبت کنید.
تعریف
ابتدا بیایید سعی کنیم بفهمیم این اصطلاح چیست. حالت اکسیداسیون طبق جدول تناوبی تعداد الکترون هایی است که توسط یک عنصر در فرآیند برهمکنش شیمیایی پذیرفته شده یا داده می شود. می تواند هم ارزش منفی و هم ارزش مثبت داشته باشد.
پیوند به جدول
حالت اکسیداسیون چگونه تعیین می شود؟ جدول تناوبی شامل هشت گروه است که به صورت عمودی مرتب شده اند. هر یک از آنها دارای دو زیر گروه است: اصلی و فرعی. به منظور تعیین شاخص برای عناصر، قوانین خاصی باید استفاده شود.
دستورالعمل
چگونه حالت اکسیداسیون عناصر را محاسبه کنیم؟ جدول به شما امکان می دهد به طور کامل با یک مشکل مشابه کنار بیایید. فلزات قلیایی که در گروه اول (زیرگروه اصلی) قرار دارند، حالت اکسیداسیون را در ترکیبات نشان می دهند، مطابق با +، برابر با بالاترین ظرفیت آنها است. فلزات گروه دوم (زیرگروه A) حالت اکسیداسیون 2+ دارند.
جدول به شما امکان می دهد این مقدار را نه تنها برای عناصری که خواص فلزی دارند، بلکه برای غیر فلزات نیز تعیین کنید. حداکثر مقدار آنها با بالاترین ظرفیت مطابقت دارد. به عنوان مثال، برای گوگرد +6، برای نیتروژن +5 خواهد بود. حداقل (کمترین) رقم آنها چگونه محاسبه می شود؟ جدول نیز به این سوال پاسخ می دهد. عدد گروه را از هشت کم کنید. به عنوان مثال، برای اکسیژن -2 و برای نیتروژن -3 خواهد بود.
برای مواد ساده ای که وارد برهمکنش شیمیایی با مواد دیگر نشده اند، شاخص تعیین شده صفر در نظر گرفته می شود.
بیایید سعی کنیم اقدامات اصلی مربوط به آرایش در ترکیبات دوتایی را شناسایی کنیم. چگونه درجه اکسیداسیون را در آنها قرار دهیم؟ جدول تناوبی به حل مشکل کمک می کند.
به عنوان مثال، اکسید کلسیم CaO را مصرف کنید. برای کلسیم واقع در زیرگروه اصلی گروه دوم، مقدار ثابت برابر با 2+ خواهد بود. برای اکسیژن، که دارای خواص غیر فلزی است، این نشانگر یک مقدار منفی خواهد بود و مطابق با -2 است. برای بررسی صحت تعریف، اعداد به دست آمده را خلاصه می کنیم. در نتیجه، ما صفر می شویم، بنابراین، محاسبات صحیح است.
اجازه دهید شاخص های مشابه را در یک ترکیب دوتایی دیگر CuO تعیین کنیم. از آنجایی که مس در یک زیر گروه ثانویه (گروه اول) قرار دارد، بنابراین، شاخص مورد مطالعه ممکن است نشان دهد معانی مختلف. بنابراین، برای تعیین آن، ابتدا باید شاخص اکسیژن را شناسایی کنید.
برای یک غیر فلزی که در انتهای فرمول دوتایی قرار دارد، حالت اکسیداسیون دارای مقدار منفی است. از آنجایی که این عنصر در گروه ششم قرار دارد، با تفریق شش از هشت، دریافت می کنیم که حالت اکسیداسیون اکسیژن با -2 مطابقت دارد. از آنجایی که هیچ شاخصی در ترکیب وجود ندارد، بنابراین، حالت اکسیداسیون مس مثبت برابر با 2 + خواهد بود.
چگونه از جدول شیمی استفاده می شود؟ حالت های اکسیداسیون عناصر در فرمول های متشکل از سه عنصر نیز بر اساس الگوریتم خاصی محاسبه می شود. ابتدا این شاخص ها در اولین و آخرین عنصر قرار می گیرند. برای اولین بار، این شاخص دارای یک مقدار مثبت است، مطابق با ظرفیت. برای عنصر افراطی، که یک غیر فلز است، این شاخص دارای یک مقدار منفی است، به عنوان یک تفاوت تعیین می شود (عدد گروه از هشت کم می شود). هنگام محاسبه حالت اکسیداسیون عنصر مرکزی، از یک معادله ریاضی استفاده می شود. محاسبات شاخص های موجود برای هر عنصر را در نظر می گیرند. مجموع تمام حالت های اکسیداسیون باید صفر باشد.
نمونه ای از تعیین در اسید سولفوریک
فرمول این ترکیب H 2 SO 4 است. هیدروژن دارای حالت اکسیداسیون 1+ و اکسیژن دارای 2- است. برای تعیین حالت اکسیداسیون گوگرد، یک معادله ریاضی می سازیم: + 1 * 2 + X + 4 * (-2) = 0. دریافت می کنیم که حالت اکسیداسیون گوگرد مطابق با +6 است.
نتیجه
هنگام استفاده از قوانین، می توانید ضرایب را در واکنش های ردوکس ترتیب دهید. این موضوع در درس شیمی پایه نهم برنامه درسی مدارس مورد توجه قرار گرفته است. علاوه بر این، اطلاعات در مورد درجات اکسیداسیون به شما امکان می دهد وظایف OGE و Unified State Examination را تکمیل کنید.
درجه اکسیداسیون. تعیین حالت اکسیداسیون اتم یک عنصر با فرمول شیمیایی ترکیب. تدوین فرمول ترکیب با توجه به حالت های اکسیداسیون شناخته شده اتم های عناصر
حالت اکسیداسیون یک عنصر، بار مشروط یک اتم در یک ماده است که با این فرض محاسبه می شود که از یون تشکیل شده است. برای تعیین درجه اکسیداسیون عناصر، لازم است قوانین خاصی را به خاطر بسپارید:
1. حالت اکسیداسیون می تواند مثبت، منفی یا صفر باشد. نشان داده شده است عدد عربیبا علامت مثبت یا منفی بالای نماد عنصر.
2. هنگام تعیین حالت های اکسیداسیون، آنها از الکترونگاتیوی ماده حاصل می شوند: مجموع حالت های اکسیداسیون همه اتم های ترکیب صفر است.
3. اگر ترکیب از اتم های یک عنصر (در یک ماده ساده) تشکیل شده باشد، حالت اکسیداسیون این اتم ها صفر است.
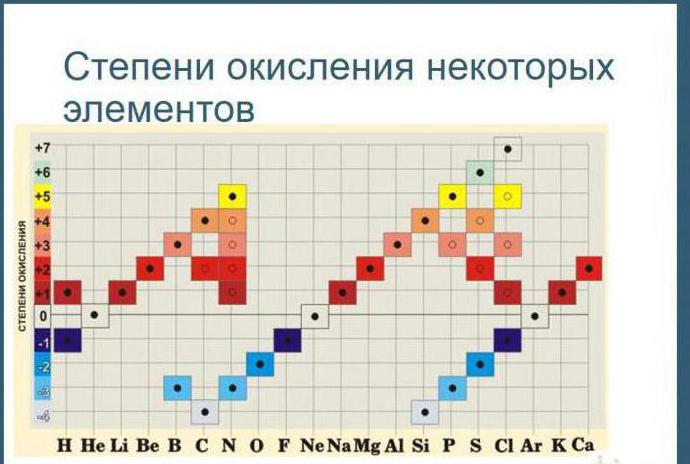
4. اتم های برخی از عناصر شیمیایی معمولاً به فولاد حالت اکسیداسیون نسبت می دهند. به عنوان مثال، حالت اکسیداسیون فلوئور در ترکیبات همیشه -1 است. لیتیوم، سدیم، پتاسیم، روبیدیم و سزیم +1؛ منیزیم، کلسیم، استرانسیم، باریم و روی +2، آلومینیوم +3.
5. حالت اکسیداسیون هیدروژن در اکثر ترکیبات +1 است و فقط در ترکیبات با برخی فلزات برابر با 1- است (KH, BaH 2).
6. حالت اکسیداسیون اکسیژن در اکثر ترکیبات 2- است و فقط در برخی ترکیبات حالت اکسیداسیون 1- به آن اختصاص می یابد (H 2 O 2 , Na 2 O 2 یا +2 (OF 2 ).
7. اتم های بسیاری از عناصر شیمیایی حالت های اکسیداسیون متغیری از خود نشان می دهند.
8. حالت اکسیداسیون اتم فلز در ترکیبات مثبت و از نظر عددی برابر با ظرفیت آن است.
9. حداکثر حالت اکسیداسیون مثبت یک عنصر معمولاً برابر است با عدد گروه در سیستم تناوبی که عنصر در آن قرار دارد.
10. حداقل حالت اکسیداسیون برای فلزات صفر است. برای غیر فلزات، در بیشتر موارد، حالت اکسیداسیون منفی کمتر برابر با اختلاف بین عدد گروه و عدد هشت است.
11. حالت اکسیداسیون یک اتم یک یون ساده (شامل یک اتم)، برابر با بار این یون را تشکیل می دهد.
با استفاده از قوانین فوق، حالت های اکسیداسیون عناصر شیمیایی در ترکیب H 2 SO 4 را تعیین می کنیم. این یک ماده پیچیده است که از سه عنصر شیمیایی تشکیل شده است - هیدروژن H، گوگرد S و اکسیژن O. ما به حالات اکسیداسیون عناصری که برای آنها ثابت هستند توجه می کنیم. در مورد ما، این هیدروژن H و اکسیژن O: است.
اجازه دهید وضعیت اکسیداسیون ناشناخته گوگرد را تعیین کنیم. حالت اکسیداسیون گوگرد در این ترکیب را x: فرض کنید.
بیایید با ضرب کردن شاخص هر عنصر در حالت اکسیداسیون معادلات را بسازیم و مقدار استخراج شده را با صفر برابر کنیم: 2 (+1) + x + 4 (-2) = 0
بنابراین، حالت اکسیداسیون گوگرد به اضافه شش است:.
در مثال زیر متوجه خواهیم شد که چگونه می توانید فرمول ترکیبی بنویسید درجات شناخته شدهاکسیداسیون اتم های عنصر بیایید فرمول اکسید فروم (III) را بسازیم. کلمه "اکسید" به این معنی است که در سمت راست نماد آهن، علامت اکسیژن باید نوشته شود: FeO.
به حالت اکسیداسیون عناصر شیمیایی در بالای نماد آنها توجه کنید. وضعیت اکسیداسیون آهن در نام در براکت (III) نشان داده شده است، بنابراین، برابر با +3 است، حالت اکسیداسیون اکسیژن در اکسیدها -2: است.
بیایید کمترین مضرب مشترک را برای اعداد 3 و 2 پیدا کنیم، این 6 است. عدد 6 را بر 3 تقسیم کنید، عدد 2 را به دست می آوریم - این شاخص آهن است. عدد 6 را بر 2 تقسیم کنید، عدد 3 را به دست می آوریم - این شاخص برای اکسیژن است:.
در مثال زیر، بیایید دریابیم که چگونه یک فرمول ترکیبی با حالت های اکسیداسیون شناخته شده اتم های عنصر و بارهای یونی فرموله کنیم. بیایید فرمولی از ارتوفسفات کلسیم بسازیم. کلمه "اورتو فسفات" به این معنی است که در سمت راست نماد کلسیم، باقی مانده اسید اسید اورتوفسفات باید نوشته شود: CaPO 4.
به حالت اکسیداسیون کلسیم (قانون شماره چهار) و بار باقیمانده اسید (طبق جدول حلالیت) توجه کنید:
بیایید کمترین مضرب مشترک را برای اعداد 2 و 3 پیدا کنیم، این 6 است. عدد 6 را بر 2 تقسیم کنید، عدد 3 را به دست می آوریم - این شاخص کلسیم است. عدد 6 را بر 3 تقسیم کنید، عدد 2 را به دست می آوریم - این شاخص برای باقی مانده اسید است:.
شبکه های کریستالی
شبکه های کریستالی. بلورهای اتمی، مولکولی و یونی. وابستگی خواص فیزیکی مواد به انواع شبکه های کریستالی
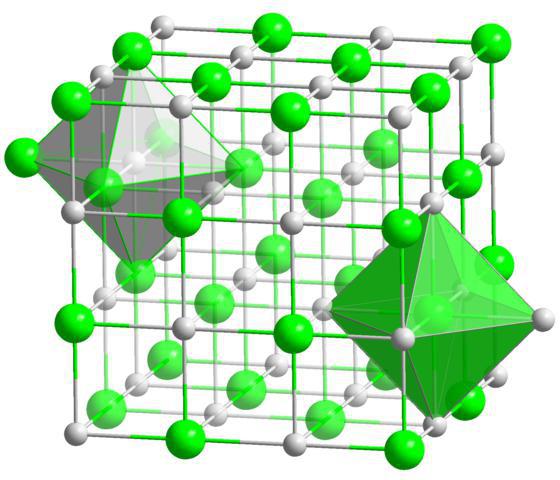
در مواد کریستالی، اتمها، مولکولها و یونها در فواصل معینی بهطور منظم قرار گرفتهاند. چنین آرایش منظمی از ذرات در کریستال ها شبکه کریستالی نامیده می شود. بسته به اینکه کدام ذرات در گره های این شبکه قرار دارند، شبکه های کریستالی یونی، اتمی و مولکولی متمایز می شوند. شبکه های کریستالی فلزی نیز شناخته شده اند.
شبکه های کریستالی یونی مشخصه ترکیباتی با پیوند شیمیایی یونی هستند. در محل چنین شبکه هایی یون هایی با بار مخالف وجود دارند. نیروهای برهمکنش بین یونی بسیار قابل توجه است، بنابراین مواد با این نوع شبکه کریستالی غیر فرار، جامد، نسوز هستند، محلول ها و مذاب آنها جریان الکتریکی را هدایت می کنند. نمایندگان معمولیچنین ترکیباتی نمک ها هستند، به عنوان مثال، کلرید سدیم، نیترات پتاسیم و غیره.
شبکه های کریستالی اتمی مشخصه ترکیباتی با نوع کووالانسی پیوند شیمیایی هستند. در محل چنین شبکه هایی اتم های مجزا وجود دارد که با پیوندهای کووالانسی محدود شده اند. همه پیوندها برابر و قوی هستند، بنابراین مواد با این نوع شبکه کریستالی با سختی بالا مشخص می شوند. دمای بالاذوب، بی اثری شیمیایی. این نوع شبکه کریستالی برای الماس، اکسید سیلیکون (IV) و بور معمولی است.
شبکه های کریستالی مولکولی مشخصه ترکیباتی با نوع کووالانسی پیوند شیمیایی هستند. محل چنین شبکه هایی حاوی مولکول های غیر قطبی یا قطبی است. به دلیل نیروهای اندرکنش ضعیف، مواد دارای این نوع شبکه کریستالی دارای سختی کم، نقطه ذوب و جوش کم بوده و با فراریت مشخص می شوند. این نوع شبکه کریستالی برای اکسیژن، ید، آب، گلوکز، الکل ها، نفتالین معمولی است.
بنابراین رابطه مشخصی بین نوع شبکه کریستالی و مشخصات فیزیکیمواد بنابراین، اگر ساختار یک ماده مشخص باشد، می توان خواص آن را پیش بینی کرد و بالعکس، اگر خواص یک ماده مشخص باشد، می توان ساختار آن را تعیین کرد.
پیوند کووالانسی، انواع آن - قطبی و غیر قطبی
پیوند کووالانسی، انواع آن - قطبی و غیر قطبی. تشکیل پیوند کووالانسی غیر قطبی. تشکیل پیوند قطبی کووالانسی. فرمول های الکترونیکی مولکول های مواد
پیوند کووالانسییک پیوند شیمیایی است که از اشتراک جفت الکترون ایجاد می شود.
اجازه دهید مکانیسم تشکیل پیوند کووالانسی را با استفاده از مثال یک مولکول هیدروژن H2 در نظر بگیریم. اتم های هیدروژن فرمول الکترونیکی دارند: 1 H 1s 1 .
هنگامی که دو اتم هیدروژن به یکدیگر نزدیک می شوند، دو الکترون با اسپین های ضد موازی (الکترون ها با فلش هایی از جهات مختلف نشان داده می شوند) با تشکیل یک جفت الکترون مشترک (مشترک) برهم کنش می کنند.
طرح تشکیل یک پیوند کووالانسی را می توان با نشان دادن الکترون جفت نشده سطح بیرونی با یک نقطه و جفت الکترون مشترک با دو نقطه نشان داد. یک جفت الکترون مشترک، به عنوان مثال. پیوند کووالانسی که اغلب با یک میله نشان داده می شود. یک جفت الکترون مشترک در نتیجه همپوشانی اوربیتال های s اتم های هیدروژن تشکیل می شود، در حالی که چگالی الکترونی افزایش یافته در ناحیه اوربیتال های همپوشانی ایجاد می شود.
تشکیل پیوند کووالانسی در یک مولکول کلر Cl2 را در نظر بگیرید. اتم های کلر دارای فرمول الکترونیکی هستند: 17 Cl 1s 2 2s 2 2p 6 3s 2 3p 5.
اتم کلر دارای هفت الکترون در سطح انرژی بیرونی خود است و یک الکترون جفت نشده در سطوح فرعی 3p. وقتی دو اتم کلر به هم می رسند، اوربیتال های 3p با الکترون های جفت نشده همپوشانی پیدا می کنند و یک جفت الکترون مشترک تشکیل می شود. هر اتم کلر در مولکول Cl 2 سه جفت الکترون مشترک (که متعلق به یک اتم است) ذخیره می کند.
در مولکول هیدروژن H2، مانند مولکول کلر Cl 2، یک پیوند ساده (تک) تشکیل می شود. مولکول هایی وجود دارند که در آنها دو یا سه جفت الکترون بین دو اتم ظاهر می شوند. چنین پیوندهای کووالانسی به ترتیب دو یا سه گانه نامیده می شوند. نام رایج پیوندهای دوگانه و سه گانه، پیوندهای چندگانه است.
به عنوان مثال، تشکیل یک پیوند کووالانسی در مولکول اکسیژن O 2 را در نظر بگیرید. اتم های اکسیژن فرمول الکترونیکی دارند: 8 O 1s 2 2s 2 2p 4 .
اتم اکسیژن دارای شش الکترون در سطح انرژی بیرونی خود است، با دو الکترون جفت نشده در سطوح فرعی 2p. در تشکیل پیوند شیمیایی در مولکول O 2، دو الکترون از هر اتم اکسیژن نقش دارند. که در این مورددو جفت الکترون مشترک (پیوند دوگانه) تشکیل می شود. هر اتم اکسیژن در مولکول O 2 دو جفت الکترون مشترک را ذخیره می کند.
هنگامی که یک پیوند کووالانسی در یک مولکول هیدروژن تشکیل می شود، هر یک از اتم های هیدروژن به دلیل تشکیل یک جفت الکترون مشترک، یک پیکربندی دو الکترونی پایدار است. در موارد دیگر، هنگامی که یک پیوند کووالانسی تشکیل می شود، برای مثال، در مولکول های کلر و اکسیژن، هر یک از اتم ها یک پیکربندی پایدار متشکل از هشت الکترون است.
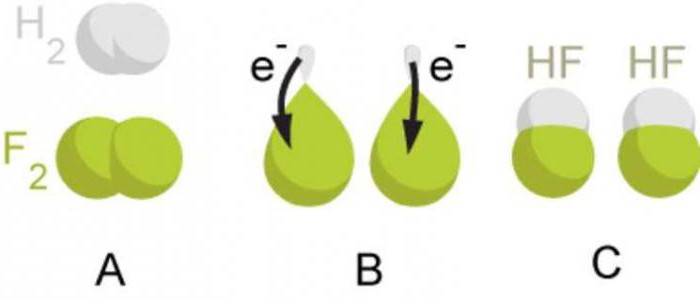
در مورد هر سه مولکول در نظر گرفته شده (هیدروژن، کلر و اکسیژن)، یک پیوند کووالانسی بین اتمها با الکترونگاتیوی یکسان تشکیل شد. چنین برهمکنشی در هنگام تشکیل مواد غیرفلزی ساده مشاهده می شود که مولکول های آنها از دو اتم یکسان تشکیل شده است. در این مورد، جفت الکترون های مشترک به طور متقارن بین هسته اتم ها قرار دارند، آنها به هم متصل می شوند. در نتیجه، مولکول هایی تشکیل می شوند که در آنها مراکز بارهای مثبت و منفی بر هم منطبق هستند.
بنابراین، پیوند کووالانسی که بین اتمهایی با الکترونگاتیوی یکسان به دلیل جفتهای الکترون مشترک ایجاد میشود، پیوند کووالانسی غیرقطبی نامیده میشود. باید به خاطر داشت که این نوع پیوند شیمیایی در مواد غیرفلزی ساده ایجاد می شود. به عنوان نمونه هایی از مواد با نوع پیوند غیرقطبی کووالانسی، می توان فلوئور F 2، برم Br 2، ید I 2، نیتروژن N 2 را نام برد.
اگر اتم های برهم کنش الکترونگاتیوی متفاوتی داشته باشند (اتم های عناصر شیمیایی مختلف)، جفت الکترون مشترک به سمت اتم با الکترونگاتیوی بیشتر جابه جا می شود. در این حالت، یک بار منفی جزئی بر روی اتمی با الکترونگاتیوی بالاتر و یک بار مثبت جزئی بر روی اتمی با الکترونگاتیوی پایینتر تشکیل میشود. این بارهای جزئی در مقدار مطلق کمتر از واحد هستند.
به عنوان مثال، هنگامی که یک مولکول کلرید هیدروژن HCl تشکیل می شود، اوربیتال s اتم هیدروژن و اوربیتال p اتم کلر همپوشانی دارند. جفت الکترون مشترک با توجه به مراکز اتم های برهم کنش غیر متقارن قرار دارد. به سمت کلر الکترونگاتیو تر حرکت می کند. اتم کلر دارای بار منفی جزئی و اتم هیدروژن دارای بار مثبت جزئی است. در این حالت، مراکز بارهای مثبت و منفی در مولکول بر هم منطبق نیستند. این گونه مولکول ها قطبی یا دوقطبی نامیده می شوند. دوقطبی سیستمی متشکل از دو بار است که از نظر قدر مساوی اما از نظر علامت مخالف هستند.
بنابراین، پیوند کووالانسی که بین اتم هایی که الکترونگاتیوی آنها متفاوت است، اما اندکی تشکیل می شود، پیوند قطبی کووالانسی نامیده می شود. لازم به یادآوری است که این نوع پیوند شیمیایی در مواد پیچیده ای که توسط اتم های غیر فلزی تشکیل شده است تشکیل می شود. به عنوان نمونه هایی از مواد با نوع پیوند قطبی کووالانسی، می توان هیدروژن فلوراید HF، آب H 2 O، آمونیاک NH 3، متان CH 4، کربن (IV) اکسید CO 2 را نام برد.
یک پیوند یونی از انتقال کامل یک یا چند الکترون از یک اتم به اتم دیگر تشکیل می شود. این نوع پیوند فقط بین اتم های عناصری که الکترونگاتیوی آنها به طور قابل توجهی متفاوت است امکان پذیر است. در این حالت یک الکترون از اتمی با الکترونگاتیوی کمتر به اتمی با الکترونگاتیوی بالاتر حرکت می کند. باید به خاطر داشت که این نوع پیوند شیمیایی بین اتم های فلزات و غیر فلزات تشکیل می شود. به عنوان مثال، عناصر گروه اول و دوم از زیر گروه های اصلی سیستم دوره ای(فلزات معمولی) مستقیماً با عناصر گروه ششم و هفتم از زیر گروه های اصلی سیستم تناوبی (غیر فلزات معمولی) ترکیب می شوند.
اجازه دهید مکانیسم تشکیل پیوند یونی در ترکیب کلرید پتاسیم را در نظر بگیریم. اتم پتاسیم حاوی یک الکترون ظرفیتی است (که با تعداد گروهی که پتاسیم در آن قرار دارد تعیین می شود). اتم کلر حاوی هفت الکترون ظرفیتی است (که با تعداد گروهی که کلر در آن قرار دارد تعیین می شود). وقتی اتمهای پتاسیم با اتمهای کلر برهمکنش میکنند، الکترون ظرفیت اتم پتاسیم به طور کامل به سطح بیرونی اتم کلر میرود و آن را در یک ساختار هشت الکترونی تکمیل میکند. در این حالت، اتم پتاسیم با از دست دادن یک الکترون، بار مثبت +1 به دست می آورد و به کاتیون K + تبدیل می شود و اتم کلر با افزودن یک الکترون، بار منفی -1 به دست می آورد و به آنیون Cl- تبدیل می شود. یون های دارای بار مخالف در اثر نیروهای الکترواستاتیکی جذب می شوند و ترکیب کلرید پتاسیم تشکیل می شود. این فرآیند را می توان با یک نمودار نشان داد:
فقط برخی از عناصر شیمیایی (گازهای نجیب) در شرایط عادی در حالت گاز تک اتمی قرار دارند. اتم های عناصر دیگر، برعکس، به صورت جداگانه وجود ندارند، بلکه بخشی از مولکول ها یا شبکه های کریستالی هستند که از ترکیبی از اتم ها تشکیل شده اند. بنابراین، دلیلی وجود دارد که اتم ها با یکدیگر پیوند دارند. این دلیل یک پیوند شیمیایی است، به این دلیل که بین اتم ها نیروهای الکترواستاتیک خاصی وجود دارد که می توانند اتم ها را به یکدیگر نگه دارند. ثابت شده است که در تشکیل پیوند شیمیایی بین اتم ها نقش اصلیمتعلق به الکترون های ظرفیت (الکترون های سطح بیرونی، ضعیف با هسته) است.
بر اساس تئوری پیوند شیمیایی، پوسته های بیرونی متشکل از دو یا هشت الکترون دارای بیشترین استحکام هستند. گازهای نجیب دارای چنین پوسته های الکترونی هستند. به همین دلیل است که گازهای نجیب در شرایط عادی وارد واکنش های شیمیایی با عناصر دیگر نمی شوند. اتم هایی با کمتر از هشت (یا دو) الکترون در سطح بیرونی خود سعی می کنند ساختارهای گاز نجیب را به دست آورند. بنابراین، هنگامی که یک مولکول در جریان یک واکنش شیمیایی تشکیل می شود، اتم ها سعی می کنند یک پوسته هشت الکترونی یا دو الکترونی پایدار به دست آورند.
تشکیل یک پیکربندی الکترونیکی پایدار می تواند به روش های مختلفی رخ دهد و منجر به تشکیل مولکول ها یا ترکیبات غیر مولکولی از ساختارهای مختلف شود. در نتیجه، انواع کووالانسی و یونی پیوندهای شیمیایی متمایز می شوند. علاوه بر این انواع، انواع دیگری از پیوندهای شیمیایی وجود دارد: فلزی و هیدروژنی (بین مولکولی).
بار رسمی یک اتم در ترکیبات یک کمیت کمکی است، معمولاً در توصیف خواص عناصر در شیمی استفاده می شود. این بار الکتریکی شرطی درجه اکسیداسیون است. ارزش آن در نتیجه بسیاری از فرآیندهای شیمیایی تغییر می کند. اگرچه بار رسمی است، اما به وضوح خواص و رفتار اتم ها را در واکنش های ردوکس (ORDs) مشخص می کند.
اکسیداسیون و احیا
در گذشته شیمیدانان از اصطلاح "اکسیداسیون" برای توصیف برهمکنش اکسیژن با عناصر دیگر استفاده می کردند. نام واکنش ها از نام لاتین اکسیژن - Oxygenium گرفته شده است. بعدها مشخص شد که عناصر دیگر نیز اکسید می شوند. در این مورد، آنها بازسازی می شوند - آنها الکترون ها را متصل می کنند. هر اتم در طول تشکیل یک مولکول، ساختار لایه الکترونی ظرفیت خود را تغییر می دهد. در این مورد، یک بار رسمی ظاهر می شود که مقدار آن به تعداد الکترون های داده شده یا دریافتی مشروط بستگی دارد. برای مشخص کردن این مقدار، قبلاً از اصطلاح شیمیایی انگلیسی "عدد اکسیداسیون" استفاده می شد که در ترجمه به معنای "عدد اکسیداسیون" است. هنگام استفاده از آن، آنها از این فرض استفاده می کنند که الکترون های اتصال در مولکول ها یا یون ها به اتمی تعلق دارند که تعداد بیشتری دارد. ارزش بالاالکترونگاتیوی (EO). توانایی حفظ الکترون های خود و جذب آنها از اتم های دیگر به خوبی در غیر فلزات قوی (هالوژن ها، اکسیژن) بیان می شود. فلزات قوی (سدیم، پتاسیم، لیتیوم، کلسیم، سایر عناصر قلیایی و قلیایی خاکی) خواص متضادی دارند.
تعیین درجه اکسیداسیون
حالت اکسیداسیون باری است که یک اتم به دست می آورد اگر الکترون های دخیل در تشکیل پیوند به طور کامل به یک عنصر الکترونگاتیو تر منتقل شوند. موادی هستند که ساختار مولکولی ندارند (هالیدهای فلزات قلیایی و سایر ترکیبات). در این موارد، حالت اکسیداسیون با بار یون همزمان است. بار شرطی یا واقعی نشان می دهد که قبل از اینکه اتم ها حالت فعلی خود را به دست آورند، چه فرآیندی رخ داده است. حالت اکسیداسیون مثبت تعداد کل الکترون هایی است که از اتم ها حذف شده اند. معنی منفیحالت اکسیداسیون برابر با تعداد الکترون های به دست آمده است. با تغییر حالت اکسیداسیون یک عنصر شیمیایی، قضاوت می کنیم که در طی واکنش چه اتفاقی برای اتم های آن می افتد (و بالعکس). رنگ ماده تعیین می کند که چه تغییراتی در حالت اکسیداسیون رخ داده است. ترکیبات کروم، آهن و تعدادی از عناصر دیگر که در آنها ظرفیت های متفاوتی از خود نشان می دهند، رنگ های متفاوتی دارند.
مقادیر حالت اکسیداسیون منفی، صفر و مثبت

مواد ساده تشکیل می شود عناصر شیمیاییبا همان مقدار EO. در این حالت، الکترون های پیوندی به طور یکسان به تمام ذرات ساختاری تعلق دارند. بنابراین، در مواد ساده، حالت اکسیداسیون (H 0 2، O 0 2، C 0) مشخصه عناصر نیست. زمانی که اتم ها الکترون ها را می پذیرند یا ابر عمومی در جهت آنها جابه جا می شود، مرسوم است که بارها را با علامت منفی بنویسند. به عنوان مثال، F -1، O -2، C -4. با اهدای الکترون، اتم ها بار مثبت واقعی یا صوری پیدا می کنند. در اکسید OF 2، اتم اکسیژن هر کدام یک الکترون به دو اتم فلوئور اهدا می کند و در حالت اکسیداسیون O +2 قرار دارد. اعتقاد بر این است که در یک مولکول یا یک یون چند اتمی، اتم های الکترونگاتیو بیشتر تمام الکترون های اتصال را دریافت می کنند.
گوگرد عنصری است که ظرفیت ها و حالت های اکسیداسیون متفاوتی از خود نشان می دهد.
عناصر شیمیایی زیر گروه های اصلی اغلب ظرفیت کمتری برابر با VIII نشان می دهند. به عنوان مثال، ظرفیت گوگرد در سولفید هیدروژن و سولفیدهای فلز II است. این عنصر با ظرفیت های متوسط و بالاتر در حالت برانگیخته مشخص می شود، زمانی که اتم یک، دو، چهار یا هر شش الکترون را رها می کند و به ترتیب ظرفیت های I، II، IV، VI را نشان می دهد. همین مقادیر، فقط با علامت منفی یا مثبت، حالت های اکسیداسیون گوگرد را دارند:
- در سولفید فلوئور یک الکترون می دهد: -1;
- در سولفید هیدروژن، کمترین مقدار: -2;
- در حالت میانی دی اکسید: +4;
- در تری اکسید، اسید سولفوریک و سولفات ها: +6.
گوگرد در بالاترین حالت اکسیداسیون خود فقط الکترون ها را می پذیرد و در پایین ترین حالت خود، خواص احیایی قوی از خود نشان می دهد. بسته به شرایط، اتم های S+4 می توانند به عنوان عوامل احیا کننده یا اکسید کننده در ترکیبات عمل کنند.
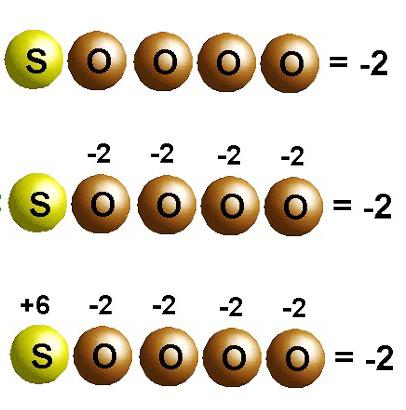
انتقال الکترون در واکنش های شیمیایی
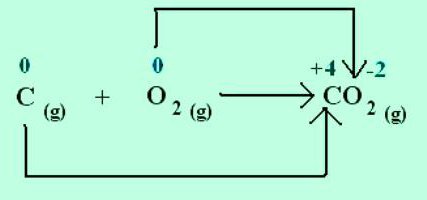
در شکل گیری یک کریستال کلرید سدیم، سدیم الکترون ها را به کلر الکترونگاتیو تر اهدا می کند. حالت های اکسیداسیون عناصر با بار یون ها منطبق است: Na +1 Cl -1 . برای مولکول های ایجاد شده توسط اجتماعی شدن و جابجایی جفت های الکترون به یک اتم الکترونگاتیو تر، فقط مفهوم بار رسمی قابل استفاده است. اما می توان فرض کرد که همه ترکیبات از یون تشکیل شده اند. سپس اتمها با جذب الکترونها، بار منفی مشروط به دست میآورند و با دفع، بار مثبت میگیرند. در واکنش ها، نشان دهید که چند الکترون جابجا شده است. به عنوان مثال، در مولکول دی اکسید کربن C + 4 O - 2 2، شاخص نشان داده شده در گوشه سمت راست بالای نماد شیمیایی کربن، تعداد الکترون های حذف شده از اتم را نشان می دهد. اکسیژن موجود در این ماده حالت اکسیداسیون 2- دارد. شاخص مربوطه با علامت شیمیایی O تعداد الکترون های اضافه شده در اتم است.
نحوه محاسبه حالت های اکسیداسیون
شمارش تعداد الکترون های اهدایی و اضافه شده توسط اتم ها می تواند زمان بر باشد. قوانین زیر این کار را آسان تر می کند:
- در مواد ساده، حالت های اکسیداسیون صفر است.
- مجموع اکسیداسیون تمام اتم ها یا یون ها در یک ماده خنثی صفر است.
- در یک یون کمپلکس، مجموع حالت های اکسیداسیون همه عناصر باید با بار کل ذره مطابقت داشته باشد.
- یک اتم الکترونگاتیو تر حالت اکسیداسیون منفی پیدا می کند که با علامت منفی نوشته می شود.
- عناصر الکترونگاتیو کمتر حالت اکسیداسیون مثبت را دریافت می کنند، آنها با علامت مثبت نوشته می شوند.
- اکسیژن به طور کلی حالت اکسیداسیون 2- را نشان می دهد.
- برای هیدروژن ارزش مشخصه: +1، موجود در هیدریدهای فلزی: H-1.
- فلوئور الکترونگاتیوترین عنصر از همه عناصر است، حالت اکسیداسیون آن همیشه -4 است.
- برای بیشتر فلزات، اعداد و ظرفیت های اکسیداسیون یکسان است.

حالت اکسیداسیون و ظرفیت
بیشتر ترکیبات در نتیجه فرآیندهای ردوکس تشکیل می شوند. انتقال یا جابجایی الکترون ها از یک عنصر به عنصر دیگر منجر به تغییر حالت اکسیداسیون و ظرفیت آنها می شود. اغلب این مقادیر منطبق هستند. به عنوان مترادف اصطلاح "وضعیت اکسیداسیون" می توان از عبارت " ظرفیت الکتروشیمیایی " استفاده کرد. اما استثناهایی وجود دارد، به عنوان مثال، در یون آمونیوم، نیتروژن چهار ظرفیتی است. در عین حال اتم این عنصر در حالت اکسیداسیون -3 قرار دارد. در مواد آلی، کربن همیشه چهار ظرفیتی است، اما حالت های اکسیداسیون اتم C در متان CH 4، الکل فرمیک CH 3 OH و اسید HCOOH مقادیر متفاوتی دارند: -4، -2 و +2.
واکنش های ردوکس

بسیاری از ردوکس فرآیندهای حیاتیدر صنعت، تکنولوژی، زندگی و طبیعت بی جان: احتراق، خوردگی، تخمیر، تنفس درون سلولی، فتوسنتز و سایر پدیده ها.
هنگام تدوین معادلات OVR، ضرایب با استفاده از روش تراز الکترونیکی انتخاب می شوند که در آن دسته بندی های زیر عمل می کنند:
- حالت های اکسیداسیون؛
- عامل کاهنده الکترون اهدا می کند و اکسید می شود.
- عامل اکسید کننده الکترون ها را می پذیرد و کاهش می یابد.
- تعداد الکترون های داده شده باید برابر با تعداد الکترون های متصل باشد.
جذب الکترون توسط یک اتم منجر به کاهش حالت اکسیداسیون آن (کاهش) می شود. از دست دادن یک یا چند الکترون توسط یک اتم با افزایش عدد اکسیداسیون عنصر در نتیجه واکنش ها همراه است. برای OVR، جریان بین یون های الکترولیت های قوی در محلول های آبی، نه تعادل الکترونیکی، بلکه از روش نیمه واکنش ها بیشتر استفاده می شود.
شاید خواندن آن مفید باشد:
- در هفته 17 بارداری چه احساسی دارد؟;
- آیا استفاده از اسپاسمالگون در دوران بارداری اسپاسمالگون در سه ماهه دوم مجاز است؟;
- هفته چهارم بارداری: علائم، علائم، عکس، سونوگرافی;
- آیا زنان باردار "Stodal" می توانند سرفه کنند;
- علائم و درمان فارنژیت در کودکان: توصیه متخصص اطفال فارنژیت حاد در نوزادان 7 ماهه;
- این هموگلوبین "وحشتناک".;
- میخائیل سرگیویچ گورباچف اهل کجاست؟;
- چگونه ایام روزه داری را برای سلامتی و کاهش وزن بگذرانیم چگونه روزهای روزه داری را برای خود درست ترتیب دهیم;