Kako izračunati najnižje oksidacijsko stanje. Kakšna je stopnja oksidacije? Kako določiti oksidacijsko stanje elementov?
Tak predmet šolski kurikulum Ker kemija večini sodobnih šolarjev povzroča številne težave, le redki znajo določiti stopnjo oksidacije v spojinah. Največ težav imajo šolarji, ki se učijo anorgansko kemijo, torej učenci osnovne šole (8.-9. razred). Nerazumevanje predmeta vodi do pojava sovražnosti med učenci do tega predmeta.
Učitelji ugotavljajo številne razloge za takšno "nenaklonjenost" srednješolcev in srednješolcev do kemije: nepripravljenost razumeti zapletene kemijske izraze, nezmožnost uporabe algoritmov za upoštevanje določenega procesa, težave z matematičnim znanjem. Ministrstvo za izobraževanje Ruske federacije je resno spremenilo vsebino predmeta. Poleg tega so »oklestili« tudi število ur za pouk kemije. To je negativno vplivalo na kakovost znanja predmeta, zmanjšanje zanimanja za študij discipline.
Katere teme tečaja kemije so za šolarje najtežje?
Avtor: nov program potek akademske discipline "Kemija" osnovne šole vključuje več resnih tem: periodični sistem elementov D. I. Mendelejeva, razredi anorganskih snovi, ionska izmenjava. Najtežja stvar za osmošolce je definicija oksidov.
Pravila postavitve
Najprej bi morali učenci vedeti, da so oksidi kompleksne dvoelementne spojine, ki vključujejo kisik. Predpogoj pripadnost binarne spojine razredu oksidov je drugo mesto kisika v tej spojini.
Algoritem za kislinske okside
Za začetek omenimo, da so oksidacijska stanja numerični izrazi valence elementov. ki ga tvorijo nekovine ali kovine z valenco od štiri do sedem, je drugi v takih oksidih nujno kisik.
V oksidih valenca kisika vedno ustreza dvema, lahko jo določimo iz periodnega sistema elementov D. I. Mendelejeva. Tako tipična nekovina, kot je kisik, ki je v 6. skupini glavne podskupine periodnega sistema, sprejme dva elektrona, da popolnoma dokonča svojo zunanjo energijsko raven. Nekovine v spojinah s kisikom največkrat izkazujejo višjo valenco, ki ustreza številu same skupine. Pomembno je opozoriti, da je oksidacijsko stanje kemičnih elementov indikator, ki pomeni pozitivno (negativno) število.
Nekovina na začetku formule ima pozitivno oksidacijsko stopnjo. Nekovinski kisik je stabilen v oksidih, njegov indeks je -2. Da bi preverili zanesljivost razporeditve vrednosti v kislinskih oksidih, boste morali vse številke, ki ste jih nastavili, pomnožiti z indeksi določenega elementa. Izračuni veljajo za zanesljive, če je skupna vsota vseh plusov in minusov nastavljenih stopinj 0.

Sestavljanje dvoelementnih formul
Oksidacijsko stanje atomov elementov omogoča ustvarjanje in zapisovanje spojin iz dveh elementov. Ko ustvarjate formulo, sta za začetek oba simbola napisana drug poleg drugega, ne pozabite postaviti kisika na drugo mesto. Nad vsakim od zapisanih znakov so predpisane vrednosti oksidacijskih stanj, nato pa je med najdenimi številkami število, ki bo brez ostanka deljivo z obema števkama. Ta indikator je treba ločeno razdeliti na številčno vrednost stopnje oksidacije, pri čemer dobimo indekse za prvo in drugo komponento dvoelementne snovi. Najvišje oksidacijsko stanje je številčno enako vrednosti najvišje valence tipične nekovine, ki je enaka številki skupine, kjer je nekovina v PS.
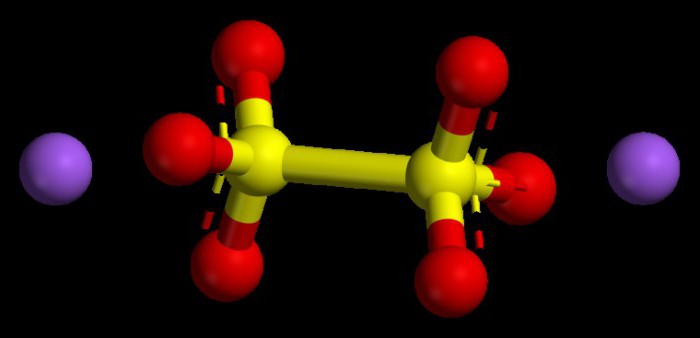
Algoritem za nastavitev numeričnih vrednosti v bazičnih oksidih
Med take spojine štejemo okside tipičnih kovin. V vseh spojinah imajo indeks oksidacijskega stanja največ +1 ali +2. Da bi razumeli, kakšno bo oksidacijsko stanje kovine, lahko uporabite periodično tabelo. Za kovine glavnih podskupin prve skupine je ta parameter vedno konstanten, podoben je številki skupine, to je +1.
Za kovine glavne podskupine druge skupine je značilno tudi stabilno oksidacijsko stanje, številčno +2. Oksidacijska stanja oksidov, ob upoštevanju njihovih indeksov (števil), bi morala biti seštevek enaka nič, saj kemična molekula velja za nevtralen delec brez naboja.
Razporeditev oksidacijskih stanj v kislinah, ki vsebujejo kisik
Kisline so kompleksne snovi, sestavljene iz enega ali več vodikovih atomov, ki so povezani z nekakšnim kislinskim ostankom. Glede na to, da so oksidacijska stanja številke, je za njihov izračun potrebno nekaj matematičnih veščin. Tak indikator za vodik (proton) v kislinah je vedno stabilen, je +1. Nato lahko določite oksidacijsko stanje za negativni kisikov ion, prav tako je stabilno, -2.
Šele po teh dejanjih je mogoče izračunati stopnjo oksidacije osrednje komponente formule. Kot poseben vzorec razmislite o določanju oksidacijskega stanja elementov v žveplovi kislini H2SO4. Glede na to, da molekula te kompleksne snovi vsebuje dva protona vodika, 4 atome kisika, dobimo izraz te oblike +2+X-8=0. Da bi vsota tvorila nič, bo imelo žveplo oksidacijsko stanje +6
Razporeditev oksidacijskih stanj v soli
Soli so kompleksne spojine, sestavljene iz kovinskih ionov in enega ali več kislinskih ostankov. Metoda za določanje oksidacijskih stanj vsakega od sestavnih delov v kompleksni soli je enak kot v kislinah, ki vsebujejo kisik. Glede na to, da je oksidacijsko stanje elementov numerični indikator, je pomembno pravilno navesti oksidacijsko stanje kovine.
Če se kovina, ki tvori sol, nahaja v glavni podskupini, bo njeno oksidacijsko stanje stabilno, ustreza številki skupine, je pozitivna vrednost. Če sol vsebuje kovino podobne podskupine PS, je mogoče s kislinskim ostankom prikazati različne kovine. Ko je oksidacijsko stanje kovine nastavljeno, postavite (-2), nato pa oksidacijsko stanje osrednjega elementa izračunate s kemijsko enačbo.
Kot primer upoštevajte določitev oksidacijskih stanj elementov v (srednji soli). NaNO3. Sol tvori kovina glavne podskupine skupine 1, zato bo oksidacijsko stanje natrija +1. Kisik v nitratih ima oksidacijsko stopnjo -2. Za določitev številčne vrednosti stopnje oksidacije je enačba +1+X-6=0. Če rešimo to enačbo, dobimo, da mora biti X +5, to je

Osnovni pojmi v OVR
Tako za oksidativni kot redukcijski proces obstajajo posebni izrazi, ki se jih morajo učenci naučiti.
Oksidacijsko stanje atoma je njegova neposredna sposobnost, da nase veže (daruje drugim) elektrone iz nekaterih ionov ali atomov.
Nevtralni atomi ali nabiti ioni veljajo za oksidant. kemijska reakcija sprejemanje elektronov.
Reducent bodo nenabiti atomi ali nabiti ioni, ki v procesu kemijske interakcije izgubijo lastne elektrone.
Oksidacija je predstavljena kot postopek darovanja elektronov.
Redukcija je povezana s sprejemom dodatnih elektronov s strani nenabitega atoma ali iona.
Za redoks proces je značilna reakcija, med katero se oksidacijsko stanje atoma nujno spremeni. Ta definicija vam omogoča razumevanje, kako lahko ugotovite, ali je reakcija OVR.

Pravila za razčlenjevanje OVR
S tem algoritmom lahko uredite koeficiente v kateri koli kemijski reakciji.
Zadnji korak bo razporeditev stereokemičnih koeficientov v obravnavani reakciji.
Primer OVR
Najprej morate urediti oksidacijska stanja v vsaki kemični snovi. Upoštevajte, da je oksidacijsko stanje nič, ker ni povratka (pritrjevanja) negativnih delcev. Pravila za razporeditev oksidacijskih stanj v binarnih in trielementnih snoveh smo obravnavali zgoraj.
Nato morate določiti tiste atome ali ione, pri katerih so se med transformacijo spremenila oksidacijska stanja.
Na levi strani zapisane enačbe so izolirani atomi oziroma nabiti ioni, ki so spremenili svoja oksidacijska stanja. To je potrebno za bilanco stanja. Nad elementi morajo biti navedene njihove vrednosti.
Nadalje se zabeležijo tisti atomi ali ioni, ki so nastali med reakcijo, označeni z znakom +, število elektronov, ki jih atom sprejme, - število oddanih negativnih delcev. Če se po procesu interakcije oksidacijska stanja zmanjšajo. To pomeni, da je atom (ion) sprejel elektrone. S povečanjem stopnje oksidacije atom (ion) med reakcijo oddaja elektrone.
Vsaj skupno število deljeno najprej s prejetimi elektroni, nato z oddanimi elektroni v procesu, dobimo koeficiente. Najdene številke bodo želeni stereokemični koeficienti.
Določite oksidant, reducent, procese, ki se pojavljajo med reakcijo.
Razmislite o praktični uporabi tega algoritma za določeno kemično reakcijo.
Fe+CuSO4=Cu+FeSO4
Indikatorje izračunamo za vse enostavne in kompleksne snovi.
Ker sta Fe in Cu enostavni snovi, je njuno oksidacijsko stanje 0. V CuSO4, nato Cu + 2, nato ima kisik -2, žveplo pa +6. V FeSO4: Fe +2, torej za O-2, po izračunih S +6.
Zdaj iščemo elemente, ki bi lahko spremenili indikatorje, v naši situaciji bosta to Fe in Cu.
Ker je po reakciji vrednost atoma železa postala +2, sta bila v reakciji odpuščena 2 elektrona. Baker je spremenil svoje indikatorje od +2 do 0, zato je baker sprejel 2 elektrona. Sedaj določimo število prejetih in oddanih elektronov atoma železa in dvovalentnega bakrovega kationa. Med pretvorbo je dvovalentni bakrov kation vzel dva elektrona, enako število elektronov pa je oddal atom železa.
Pri tem procesu ni smiselno določati najmanjšega skupnega večkratnika, saj se med transformacijo sprejme in odda enako število elektronov. Stereokemijski koeficienti bodo prav tako ustrezali enoti. V reakciji bo železo pokazalo lastnosti reducenta, medtem ko bo oksidirano. Dvovalentni bakrov kation se v reakciji, ki jo ima, reducira v čisti baker najvišja stopnja oksidacijo.

Uporaba procesov
Formule oksidacijskega stanja bi moral poznati vsak učenec v razredu 8-9, saj je to vprašanje vključeno v OGE naloge. Igrajo se vsi procesi, ki potekajo z oksidativnimi, redukcijskimi znaki pomembnost v našem življenju. Brez njih so presnovni procesi v človeškem telesu nemogoči.
del I
1. Oksidacijsko stanje (s. o.) je pogojni naboj atomov kemičnega elementa v kompleksni snovi, izračunan na podlagi predpostavke, da je sestavljena iz enostavnih ionov.
Moral bi vedeti!
1) V povezavi z. O. vodik = +1, razen za hidride.
2) V spojinah z. O. kisik = -2, razen peroksidov ![]() in fluoridi
in fluoridi
3) Oksidacijsko stanje kovin je vedno pozitivno.
Za kovine glavnih podskupin prvih treh skupin z. O. konstanta:
Kovine skupine IA - str. O. = +1,
Kovine skupine IIA - str. O. = +2,
Kovine skupine IIIA - str. O. = +3.
4) Za proste atome in enostavne snovi str. O. = 0.
5) Skupaj s. O. vsi elementi v spojini = 0.
2. Način tvorbe imen dvoelementne (binarne) spojine.

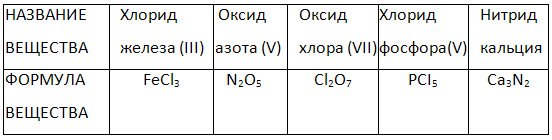
4. Izpolnite tabelo "Imena in formule binarnih spojin."
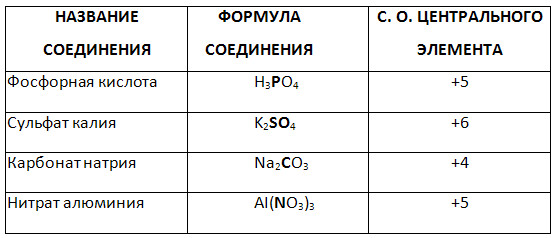
5. Določite stopnjo oksidacije označenega elementa kompleksne spojine.
del II
1. Določite oksidacijska stanja kemičnih elementov v spojinah po njihovih formulah. Zapiši imena teh snovi.

2. Ločite snovi FeO, Fe2O3, CaCl2, AlBr3, CuO, K2O, BaCl2, SO3v dve skupini. Zapišite imena snovi z navedbo stopnje oksidacije.

3. Vzpostavite ujemanje med imenom in oksidacijskim stanjem atoma kemičnega elementa in formulo spojine.

4. Poimensko sestavite formule snovi.

5. Koliko molekul vsebuje 48 g žveplovega oksida (IV)?
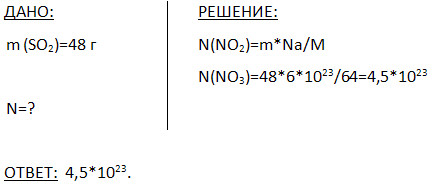
6. S pomočjo interneta in drugih virov informacij pripravite poročilo o uporabi poljubne binarne povezave po naslednjem načrtu:
1) formula;
2) ime;
3) lastnosti;
4) aplikacija.
H2O voda, vodikov oksid.
Voda pri normalne razmere tekočina, brezbarvna, brez vonja, v debelem sloju - modra. Vrelišče je približno 100⁰С. Je dobro topilo. Molekula vode je sestavljena iz dveh atomov vodika in enega atoma kisika, to je njena kvalitativna in kvantitativna sestava. To je kompleksna snov, za katero je značilno naslednje Kemijske lastnosti: interakcija z alkalijskimi kovinami, zemeljskoalkalijske kovine. Reakcije izmenjave z vodo imenujemo hidroliza. Te reakcije imajo velik pomen v kemiji.
7. Oksidacijsko stanje mangana v spojini K2MnO4 je:
3) +6
8. Krom ima najnižje oksidacijsko stanje v spojini, katere formula je:
1) Cr2O3
9. Klor kaže največje oksidacijsko stanje v spojini, katere formula je:
3) Сl2O7
Kako določiti stopnjo oksidacije? Periodni sistem vam omogoča, da zapišete dano kvantitativno vrednost za kateri koli kemični element.
Opredelitev
Najprej poskusimo razumeti, kaj je ta izraz. Oksidacijsko stanje po periodnem sistemu je število elektronov, ki jih sprejme ali odda element v procesu kemijske interakcije. Lahko ima negativne in pozitivne vrednosti.
Povezava do tabele
Kako se določi oksidacijsko stanje? Periodni sistem je sestavljen iz osmih skupin, ki so razporejene navpično. Vsaka od njih ima dve podskupini: glavno in sekundarno. Za nastavitev indikatorjev za elemente je treba uporabiti določena pravila.
Navodilo
Kako izračunati oksidacijska stanja elementov? Tabela vam omogoča, da se popolnoma spopadete s podobno težavo. Alkalijske kovine, ki se nahajajo v prvi skupini (glavna podskupina), kažejo oksidacijsko stanje v spojinah, ustreza +, je enako njihovi najvišji valenci. Kovine druge skupine (podskupina A) imajo oksidacijsko stopnjo +2.
Tabela vam omogoča, da določite to vrednost ne samo za elemente, ki kažejo kovinske lastnosti, ampak tudi za nekovine. Njihova največja vrednost bo ustrezala najvišji valenci. Na primer, za žveplo bo +6, za dušik +5. Kako se izračuna njihova minimalna (najnižja) vrednost? Tabela odgovarja tudi na to vprašanje. Odštejte številko skupine od osem. Na primer, za kisik bo -2, za dušik -3.
Za enostavne snovi, ki niso vstopile v kemično interakcijo z drugimi snovmi, se ugotovljeni indikator šteje za nič.
Poskusimo identificirati glavna dejanja, povezana z razporeditvijo v binarnih spojinah. Kako jim določiti stopnjo oksidacije? Periodni sistem pomaga rešiti problem.
Na primer, vzemite kalcijev oksid CaO. Za kalcij, ki se nahaja v glavni podskupini druge skupine, bo vrednost konstantna, enaka +2. Za kisik, ki ima nekovinske lastnosti, bo ta indikator negativna vrednost in ustreza -2. Da preverimo pravilnost definicije, dobljena števila povzamemo. Kot rezultat dobimo nič, zato so izračuni pravilni.
Določimo podobne kazalnike še v eni binarni spojini CuO. Ker se baker nahaja v sekundarni podskupini (prva skupina), se torej lahko pokaže preučevani indikator različne pomene. Zato morate za njegovo določitev najprej določiti indikator za kisik.
Pri nekovini, ki se nahaja na koncu binarne formule, ima oksidacijsko stanje negativno vrednost. Ker se ta element nahaja v šesti skupini, pri odštevanju šestih od osmih dobimo, da oksidacijsko stanje kisika ustreza -2. Ker v spojini ni indeksov, bo oksidacijsko stanje bakra pozitivno, enako +2.
Kako se sicer uporablja tabela za kemijo? Tudi oksidacijska stanja elementov v formulah, sestavljenih iz treh elementov, se izračunajo po določenem algoritmu. Najprej so ti indikatorji postavljeni na prvi in zadnji element. Prvič, ta indikator bo imel pozitivno vrednost, ustreza valenci. Za skrajni element, ki je nekovina, ima ta indikator negativno vrednost, določena je kot razlika (številka skupine se odšteje od osem). Pri izračunu oksidacijskega stanja osrednjega elementa se uporablja matematična enačba. Izračuni upoštevajo indekse, ki so na voljo za vsak element. Vsota vseh oksidacijskih stanj mora biti enaka nič.
Primer določanja v žveplovi kislini
Formula te spojine je H 2 SO 4 . Vodik ima oksidacijsko stopnjo +1, kisik -2. Za določitev oksidacijskega stanja žvepla sestavimo matematično enačbo: + 1 * 2 + X + 4 * (-2) = 0. Dobimo, da oksidacijsko stanje žvepla ustreza +6.
Zaključek
Pri uporabi pravil lahko uredite koeficiente v redoks reakcijah. To vprašanje se obravnava v tečaju kemije devetega razreda šolskega kurikuluma. Poleg tega vam informacije o stopnjah oksidacije omogočajo, da opravite naloge OGE in Enotnega državnega izpita.
Stopnja oksidacije. Določanje oksidacijskega stanja atoma elementa s kemijsko formulo spojine. Sestavljanje formule spojine glede na znana oksidacijska stanja atomov elementov
Oksidacijsko stanje elementa je pogojni naboj atoma v snovi, izračunan ob predpostavki, da je sestavljena iz ionov. Za določitev stopnje oksidacije elementov je treba zapomniti določena pravila:
1. Oksidacijsko stanje je lahko pozitivno, negativno ali nič. Označeno je arabska številka z znakom plus ali minus nad simbolom elementa.
2. Pri določanju oksidacijskih stanj izhajajo iz elektronegativnosti snovi: vsota oksidacijskih stanj vseh atomov v spojini je nič.
3. Če spojino tvorijo atomi enega elementa (v enostavni snovi), potem je oksidacijsko stanje teh atomov nič.
4. Atomom nekaterih kemijskih elementov je jeklu običajno pripisana oksidacijska stanja. Na primer, oksidacijsko stanje fluora v spojinah je vedno -1; litij, natrij, kalij, rubidij in cezij +1; magnezij, kalcij, stroncij, barij in cink +2, aluminij +3.
5. Oksidacijsko stanje vodika je v večini spojin +1, le v spojinah z nekaterimi kovinami pa je enako -1 (KH, BaH 2).
6. Oksidacijsko stanje kisika je v večini spojin -2, le nekaterim spojinam pa mu pripišemo oksidacijsko stanje -1 (H 2 O 2, Na 2 O 2 ali +2 (OF 2).
7. Atomi mnogih kemičnih elementov kažejo spremenljiva oksidacijska stanja.
8. Oksidacijsko stanje kovinskega atoma v spojinah je pozitivno in številčno enako njegovi valenci.
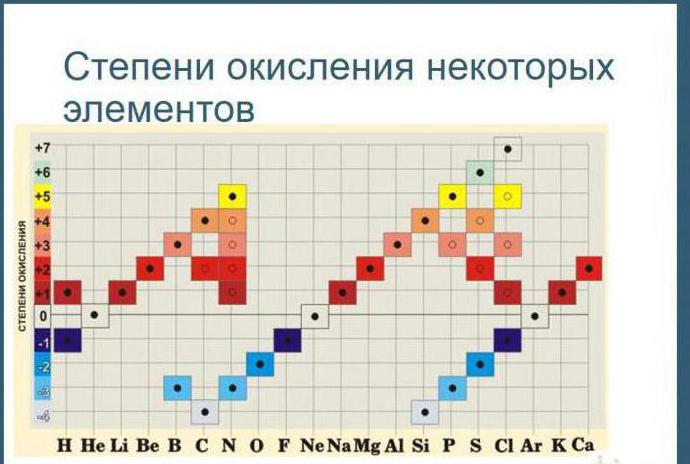
9. Najvišje pozitivno oksidacijsko stanje elementa je običajno enako številu skupine v periodnem sistemu, v katerem se element nahaja.
10. Minimalno oksidacijsko stanje za kovine je nič. Pri nekovinah je v večini primerov nižje negativno oksidacijsko stanje enako razliki med številko skupine in številko osem.
11. Oksidacijsko stanje atoma tvori preprost ion (sestavljen iz enega atoma), ki je enak naboju tega iona.
Z zgornjimi pravili določimo oksidacijska stanja kemičnih elementov v sestavi H 2 SO 4. To je kompleksna snov, sestavljena iz treh kemičnih elementov - vodika H, žvepla S in kisika O. Opažamo oksidacijska stanja tistih elementov, za katere so konstantna. V našem primeru je to vodik H in kisik O:.
Določimo neznano oksidacijsko stanje žvepla. Naj bo oksidacijsko stanje žvepla v tej spojini x:.
Naredimo enačbe tako, da za vsak element pomnožimo njegov indeks s stopnjo oksidacije in izenačimo ekstrahirano količino na nič: 2 (+1) + x + 4 (-2) = 0
Zato je oksidacijsko stanje žvepla plus šest:.
V naslednjem primeru bomo ugotovili, kako lahko napišete sestavljeno formulo z znane stopnje oksidacija atomov elementov. Sestavimo formulo železovega (III) oksida. Beseda "oksid" pomeni, da je treba desno od simbola za železo napisati simbol za kisik: FeO.
Upoštevajte oksidacijska stanja kemičnih elementov nad njihovimi simboli. Oksidacijsko stanje železa je v imenu navedeno v oklepajih (III), zato je enako +3, oksidacijsko stanje kisika v oksidih je -2:.
Poiščimo najmanjši skupni večkratnik za število 3 in 2, to je 6. Število 6 delimo s 3, dobimo število 2 – to je indeks za železo. Število 6 razdelimo na 2, dobimo številko 3 - to je indeks za kisik:.
V naslednjem primeru poglejmo, kako oblikovati formulo spojine z znanimi oksidacijskimi stanji atomov elementov in naboji ionov. Naredimo formulo kalcijevega ortofosfata. Beseda "ortofosfat" pomeni, da je treba desno od simbola kalcija napisati kislinski ostanek ortofosfatne kisline: CaPO 4.
Upoštevajte oksidacijsko stanje kalcija (četrto pravilo) in naboj kislinskega ostanka (v skladu s tabelo topnosti):
Poiščimo najmanjši skupni večkratnik za število 2 in 3, to je 6. Število 6 delimo z 2, dobimo število 3 – to je indeks za kalcij. Število 6 razdelimo na 3, dobimo številko 2 - to je indeks za kislinski ostanek:.
Kristalne mreže
Kristalne mreže. Atomski, molekularni in ionski kristali. Odvisnost fizikalnih lastnosti snovi od vrst kristalnih mrež
V kristalnih snoveh so atomi, molekule in ioni razporejeni na urejen način, na določenih razdaljah. Tako pravilno razporeditev delcev v kristalih imenujemo kristalna mreža. Glede na to, kateri delci so v vozliščih te mreže, ločimo ionske, atomske in molekularne kristalne mreže. Poznane so tudi kovinske kristalne mreže.
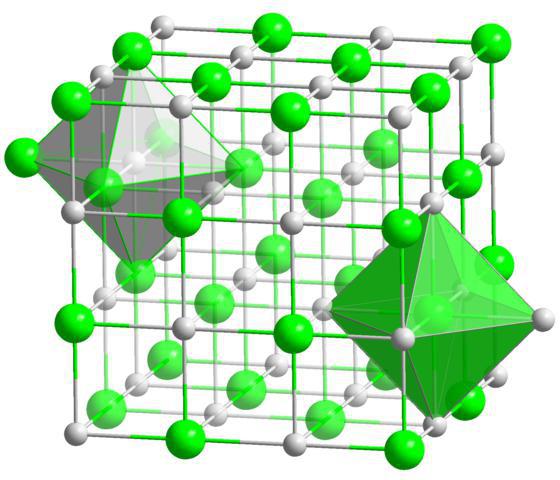
Ionske kristalne mreže so značilne za spojine z ionsko vrsto kemijske vezi. Na mestih takšnih mrež so nasprotno nabiti ioni. Sile medionske interakcije so zelo pomembne, zato so snovi s to vrsto kristalne mreže nehlapne, trdne, ognjevarne, njihove raztopine in taline prevajajo električni tok. Tipični predstavniki takšne spojine so soli, na primer natrijev klorid, kalijev nitrat in druge.
Atomske kristalne mreže so značilne za spojine s kovalentno vrsto kemijske vezi. Na mestih takšnih mrež so posamezni atomi, povezani s kovalentnimi vezmi. Vse vezi so enake in močne, zato je za snovi s to vrsto kristalne mreže značilna visoka trdota, visoke temperature taljenje, kemična inertnost. Ta vrsta kristalne mreže je značilna za diamant, silicijev (IV) oksid, bor.
Molekularne kristalne mreže so značilne za spojine s kovalentno vrsto kemijske vezi. Mesta takšnih mrež vsebujejo nepolarne ali polarne molekule. Zaradi šibkih medsebojnih sil imajo snovi s to vrsto kristalne mreže nizko trdoto, nizka tališča in vrelišča, zanje je značilna hlapnost. Ta vrsta kristalne mreže je značilna za kisik, jod, vodo, glukozo, alkohole, naftalen.
Tako obstaja določena povezava med vrsto kristalne mreže in fizične lastnosti snovi. Torej, če je zgradba snovi znana, potem je mogoče predvideti njene lastnosti in, nasprotno, če so lastnosti snovi znane, potem je mogoče določiti njeno zgradbo.
Kovalentna vez, njene vrste - polarne in nepolarne
Kovalentna vez, njene vrste - polarne in nepolarne. Tvorba kovalentne nepolarne vezi. Tvorba kovalentne polarne vezi. Elektronske formule molekul snovi
kovalentna vez je kemična vez, ki nastane z delitvijo elektronskih parov.
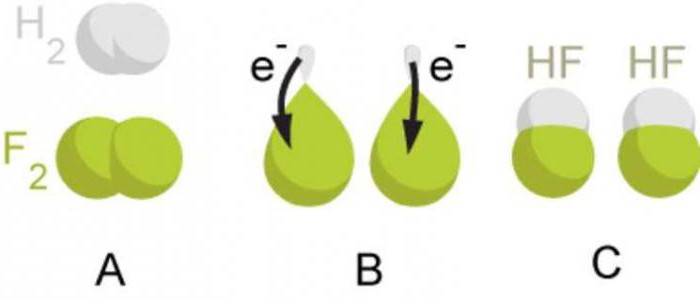
Razmislimo o mehanizmu nastanka kovalentne vezi na primeru molekule vodika H 2 . Atomi vodika imajo elektronsko formulo: 1 H 1s 1 .
Ko se dva atoma vodika približata drug drugemu, dva elektrona z antiparalelnimi vrtljaji (elektroni so označeni s puščicami iz različnih smeri) medsebojno delujeta s tvorbo skupnega (deljenega) elektronskega para.
Shemo za nastanek kovalentne vezi lahko predstavimo tako, da z eno piko označimo neparni elektron zunanjega nivoja, z dvema pikama pa skupni elektronski par. Skupni elektronski par, tj. kovalentna vez, pogosto označena s črto. Zaradi prekrivanja s-orbital vodikovih atomov nastane skupni elektronski par, v območju prekrivajočih se orbital pa se ustvari povečana elektronska gostota.
Razmislite o nastanku kovalentne vezi v molekuli klora Cl2. Atomi klora imajo elektronsko formulo: 17 Cl 1s 2 2s 2 2p 6 3s 2 3p 5.
Atom klora ima sedem elektronov na svojem zunanjem energijskem nivoju, z enim neparnim elektronom na podnivojih 3p. Ko se dva atoma klora združita, se 3p orbitale prekrivajo z neparnimi elektroni in nastane skupni elektronski par. Vsak atom klora v molekuli Cl 2 shrani tri nedeljene elektronske pare (ki pripadajo enemu atomu).
V molekuli vodika H2, tako kot v molekuli klora Cl 2, nastane enostavna (enojna) vez. Obstajajo molekule, v katerih se med dvema atomoma pojavijo dva ali trije elektronski pari. Takšne kovalentne vezi se imenujejo dvojne ali trojne. Splošno ime za dvojne in trojne vezi je večkratne vezi.
Na primer, razmislite o tvorbi kovalentne vezi v molekuli kisika O 2 . Atomi kisika imajo elektronsko formulo: 8 O 1s 2 2s 2 2p 4 .
Atom kisika ima šest elektronov na svojem zunanjem energijskem nivoju, z dvema neparnima elektronoma na podnivojih 2p. Pri tvorbi kemijske vezi v molekuli O 2 sodelujeta po dva elektrona vsakega atoma kisika. IN ta primer nastaneta dva skupna elektronska para (dvojna vez). Vsak atom kisika v molekuli O 2 shrani dva nedeljena elektronska para.
Ko se v molekuli vodika tvori kovalentna vez, je zaradi tvorbe skupnega elektronskega para vsak od vodikovih atomov stabilna dvoelektronska konfiguracija. V drugih primerih, ko nastane kovalentna vez, na primer v molekulah klora in kisika, je vsak od atomov stabilna konfiguracija, sestavljena iz osmih elektronov.
Pri vseh treh obravnavanih molekulah (vodik, klor in kisik) je nastala kovalentna vez med atomi z enako elektronegativnostjo. Takšno interakcijo opazimo med tvorbo preprostih nekovinskih snovi, katerih molekule so sestavljene iz dveh enakih atomov. V tem primeru se skupni elektronski pari nahajajo simetrično med jedri atomov, so povezani. Posledično nastanejo molekule, v katerih središča pozitivnih in negativnih nabojev sovpadajo.
Kovalentno vez, ki nastane med atomi z enako elektronegativnostjo zaradi skupnih elektronskih parov, imenujemo kovalentna nepolarna vez. Ne smemo pozabiti, da se ta vrsta kemične vezi tvori v preprostih nekovinskih snoveh. Kot primere snovi s kovalentno nepolarno vrsto vezi lahko navedemo fluor F 2, brom Br 2, jod I 2, dušik N 2.
Če imajo medsebojno delujoči atomi različno elektronegativnost (atomi različnih kemičnih elementov), se bo skupni elektronski par premaknil proti atomu z večjo elektronegativnostjo. V tem primeru se na atomu z večjo elektronegativnostjo tvori delni negativni naboj, na atomu z manjšo elektronegativnostjo pa delni pozitivni naboj. Ti delni naboji so v absolutni vrednosti manjši od enote.
Na primer, ko nastane molekula vodikovega klorida HCl, se s-orbitala atoma vodika in p-orbitala atoma klora prekrivata. Skupni elektronski par se nahaja asimetrično glede na središča medsebojno delujočih atomov. Preide k bolj elektronegativnemu kloru. Atom klora ima delni negativni naboj, atom vodika pa delni pozitivni naboj. V tem primeru središča pozitivnih in negativnih nabojev v molekuli ne sovpadajo. Takšne molekule imenujemo polarni ali dipoli. Dipol je sistem dveh nabojev, ki sta enaka po velikosti, a nasprotna po predznaku.
Tako se kovalentna vez, ki nastane med atomi, katerih elektronegativnost se razlikuje, vendar rahlo, imenuje kovalentna polarna vez. Ne smemo pozabiti, da se ta vrsta kemične vezi tvori v kompleksnih snoveh, ki jih tvorijo atomi nekovin. Kot primere snovi s kovalentno polarno vrsto vezi lahko navedemo vodikov fluorid HF, vodo H 2 O, amoniak NH 3, metan CH 4, ogljikov (IV) oksid CO 2.
Ionska vez nastane s popolnim prenosom enega ali več elektronov iz enega atoma v drugega. Ta vrsta vezi je možna le med atomi elementov, katerih elektronegativnost se bistveno razlikuje. V tem primeru se elektron premika od atoma z manjšo elektronegativnostjo do atoma z večjo elektronegativnostjo. Ne smemo pozabiti, da se ta vrsta kemične vezi tvori med atomi kovin in nekovin. Na primer, elementi prve in druge skupine glavnih podskupin periodni sistem(tipične kovine) se neposredno kombinirajo z elementi šeste in sedme skupine glavnih podskupin periodnega sistema (tipične nekovine).
Razmislimo o mehanizmu nastanka ionske vezi v sestavi kalijevega klorida. Atom kalija vsebuje en valenčni elektron (določen s številko skupine, v kateri se nahaja kalij). Atom klora vsebuje sedem valenčnih elektronov (določenih s številom skupine, v kateri se nahaja klor). Ko atomi kalija medsebojno delujejo z atomi klora, valenčni elektron atoma kalija popolnoma preide na zunanjo raven atoma klora in ga zaključi v osemelektronsko strukturo. V tem primeru atom kalija, ki izgubi elektron, pridobi pozitiven naboj +1 in se spremeni v kation K +, atom klora pa z dodajanjem elektrona pridobi negativni naboj -1 in se spremeni v anion Cl - . Nasprotno nabiti ioni se zaradi elektrostatičnih sil privlačijo in nastane spojina kalijev klorid. Ta proces lahko predstavimo z diagramom:
Le nekateri kemijski elementi (žlahtni plini) so v normalnih pogojih v stanju enoatomskega plina. Atomi drugih elementov, nasprotno, ne obstajajo posamično, ampak so del molekul ali kristalnih mrež, ki jih tvori kombinacija atomov. Torej obstaja razlog, zakaj se atomi vežejo med seboj. Ta razlog je kemična vez, ker med atomi obstajajo določene elektrostatične sile, ki lahko držijo atome drug na drugem. Dokazano je, da pri nastajanju kemične vezi med atomi glavno vlogo pripada valenčnim elektronom (elektroni zunanje ravni, šibko povezani z jedrom).
Po teoriji kemijske vezi imajo največjo trdnost zunanje lupine, sestavljene iz dveh ali osmih elektronov. Žlahtni plini imajo takšne elektronske lupine. To je razlog, zakaj žlahtni plini v normalnih pogojih ne vstopajo v kemične reakcije z drugimi elementi. Atomi z manj kot osmimi (ali dvema) elektronoma na svoji zunanji ravni poskušajo pridobiti strukture žlahtnih plinov. Ko torej med kemično reakcijo nastane molekula, poskušajo atomi pridobiti stabilno osemelektronsko ali dvoelektronsko lupino.
Tvorba stabilne elektronske konfiguracije lahko poteka na več načinov in vodi do nastanka molekul ali nemolekulskih spojin različnih struktur. Posledično se razlikujejo kovalentne in ionske vrste kemičnih vezi. Poleg teh vrst obstajajo tudi druge vrste kemičnih vezi: kovinske in vodikove (medmolekularne).
Formalni naboj atoma v spojinah je pomožna količina, običajno se uporablja pri opisih lastnosti elementov v kemiji. Ta pogojni električni naboj je stopnja oksidacije. Njegova vrednost se spreminja zaradi številnih kemičnih procesov. Čeprav je naboj formalen, nazorno označuje lastnosti in obnašanje atomov v redoks reakcijah (ORD).
Oksidacija in redukcija
V preteklosti so kemiki uporabljali izraz "oksidacija" za opis interakcije kisika z drugimi elementi. Ime reakcij izhaja iz latinskega imena za kisik - Oxygenium. Kasneje se je izkazalo, da tudi drugi elementi oksidirajo. V tem primeru se obnovijo - pritrdijo elektrone. Vsak atom med nastajanjem molekule spremeni strukturo svoje valentne elektronske lupine. V tem primeru se pojavi formalni naboj, katerega vrednost je odvisna od števila pogojno danih ali prejetih elektronov. Za označevanje te vrednosti je bil prej uporabljen angleški kemijski izraz "oxidation number", kar v prevodu pomeni "oksidacijsko število". Pri uporabi izhajajo iz predpostavke, da vezni elektroni v molekulah oziroma ionih pripadajo atomu, ki ima več visoka vrednost elektronegativnost (EO). Sposobnost zadrževanja svojih elektronov in privabljanja iz drugih atomov je dobro izražena pri močnih nekovinah (halogeni, kisik). Močne kovine (natrij, kalij, litij, kalcij, drugi alkalijski in zemeljskoalkalijski elementi) imajo nasprotne lastnosti.
Določanje stopnje oksidacije
Oksidacijsko stanje je naboj, ki bi ga pridobil atom, če bi elektrone, ki sodelujejo pri tvorbi vezi, popolnoma premaknili k bolj elektronegativnemu elementu. Obstajajo snovi, ki nimajo molekularne strukture (halogenidi alkalijskih kovin in druge spojine). V teh primerih oksidacijsko stanje sovpada z nabojem iona. Pogojni ali realni naboj kaže, kakšen proces je potekal, preden so atomi pridobili trenutno stanje. Pozitivno oksidacijsko stanje je skupno število elektronov, ki so bili odstranjeni iz atomov. Negativni pomen oksidacijsko stanje je enako številu pridobljenih elektronov. S spreminjanjem oksidacijskega stanja kemičnega elementa presojamo, kaj se med reakcijo dogaja z njegovimi atomi (in obratno). Barva snovi določa, do kakšnih sprememb v oksidacijskem stanju je prišlo. Spojine kroma, železa in številnih drugih elementov, v katerih izkazujejo različne valence, so različno obarvane.
Negativne, ničelne in pozitivne vrednosti oksidacijskega stanja

Nastanejo enostavne snovi kemični elementi z enako vrednost EO. V tem primeru pripadajo vezni elektroni vsem strukturnim delcem enako. Zato v enostavnih snoveh oksidacijsko stanje (H 0 2, O 0 2, C 0) ni značilno za elemente. Ko atomi sprejmejo elektrone ali se splošni oblak premakne v njihovo smer, je običajno zapisati naboje z znakom minus. Na primer F -1, O -2, C -4. Z oddajo elektronov atomi pridobijo realni ali formalni pozitivni naboj. V OF 2 oksidu atom kisika odda po en elektron dvema atomoma fluora in je v oksidacijskem stanju O +2. Menijo, da v molekuli ali večatomskem ionu bolj elektronegativni atomi prejmejo vse vezne elektrone.
Žveplo je element, ki ima različne valence in oksidacijska stanja.
Kemični elementi glavnih podskupin pogosto kažejo nižjo valenco, enako VIII. Na primer, valenca žvepla v vodikovem sulfidu in kovinskih sulfidih je II. Za element so značilne vmesne in višje valence v vzbujenem stanju, ko atom odda enega, dva, štiri ali vseh šest elektronov in kaže valence I, II, IV, VI. Enake vrednosti, le s predznakom minus ali plus, imajo oksidacijska stanja žvepla:
- v fluorovem sulfidu daje en elektron: -1;
- pri vodikovem sulfidu najnižja vrednost: -2;
- v dioksidnem vmesnem stanju: +4;
- v trioksidu, žveplovi kislini in sulfatih: +6.
V najvišjem oksidacijskem stanju žveplo sprejema samo elektrone, v najnižjem stanju pa kaže močne redukcijske lastnosti. Atomi S +4 lahko delujejo kot redukcijska ali oksidacijska sredstva v spojinah, odvisno od pogojev.
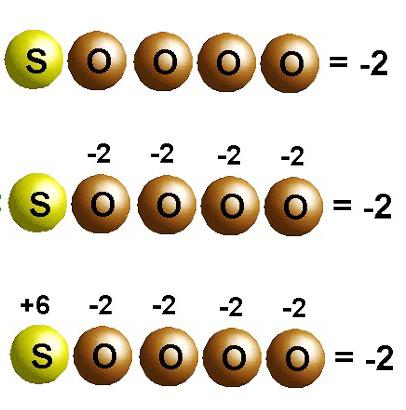
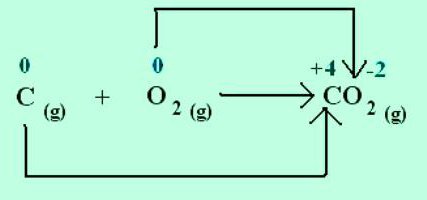
Prenos elektronov pri kemijskih reakcijah
Pri tvorbi kristala natrijevega klorida natrij odda elektrone bolj elektronegativnemu kloru. Oksidacijska stanja elementov sovpadajo z naboji ionov: Na +1 Cl -1. Za molekule, ustvarjene s socializacijo in premikom elektronskih parov k bolj elektronegativnemu atomu, velja samo koncept formalnega naboja. Lahko pa domnevamo, da so vse spojine sestavljene iz ionov. Nato atomi s privabljanjem elektronov pridobijo pogojno negativen naboj, z oddajanjem pa pridobijo pozitivnega. V reakcijah navedite, koliko elektronov je premaknjenih. Na primer, v molekuli ogljikovega dioksida C +4 O - 2 2 indeks, naveden v zgornjem desnem kotu kemijskega simbola za ogljik, prikazuje število elektronov, odstranjenih iz atoma. Kisik v tej snovi ima oksidacijsko stopnjo -2. Ustrezni indeks s kemijskim znakom O je število dodanih elektronov v atomu.
Kako izračunati oksidacijska stanja
Štetje števila elektronov, ki jih darujejo in dodajo atomi, je lahko dolgotrajno. Naslednja pravila olajšajo to nalogo:
- V enostavnih snoveh so oksidacijska stanja enaka nič.
- Vsota oksidacije vseh atomov ali ionov v nevtralni snovi je enaka nič.
- V kompleksnem ionu mora vsota oksidacijskih stanj vseh elementov ustrezati naboju celotnega delca.
- Bolj elektronegativen atom dobi negativno oksidacijsko stanje, ki ga zapišemo z minusom.
- Manj elektronegativni elementi dobijo pozitivna oksidacijska stanja, zapisani so z znakom plus.
- Kisik ima običajno oksidacijsko stopnjo -2.
- Za vodik značilna vrednost: +1, najdemo v kovinskih hidridih: H-1.
- Fluor je najbolj elektronegativen od vseh elementov, njegovo oksidacijsko stanje je vedno -4.
- Za večino kovin so oksidacijska števila in valence enaki.

Oksidacijsko stanje in valenca
Večina spojin nastane kot posledica redoks procesov. Prehod ali premik elektronov iz enega elementa v drugega vodi do spremembe njihovega oksidacijskega stanja in valence. Pogosto te vrednosti sovpadajo. Kot sinonim za izraz "oksidacijsko stanje" lahko uporabimo izraz "elektrokemična valenca". Vendar obstajajo izjeme, na primer v amonijevem ionu je dušik štirivalenten. Hkrati je atom tega elementa v oksidacijskem stanju -3. V organskih snoveh je ogljik vedno štirivalenten, vendar imajo oksidacijska stanja atoma C v metanu CH 4, mravljičnem alkoholu CH 3 OH in kislini HCOOH različne vrednosti: -4, -2 in +2.
Redoks reakcije

Veliko redoks kritičnih procesov v industriji, tehnologiji, življenju in nežive narave: zgorevanje, korozija, fermentacija, znotrajcelično dihanje, fotosinteza in drugi pojavi.
Pri sestavljanju enačb OVR se koeficienti izberejo z metodo elektronske bilance, v kateri se upravljajo naslednje kategorije:
- oksidacijska stanja;
- redukcijsko sredstvo odda elektrone in se oksidira;
- oksidant sprejme elektrone in se reducira;
- število danih elektronov mora biti enako številu pripetih.
Pridobivanje elektronov s strani atoma vodi do zmanjšanja njegovega oksidacijskega stanja (redukcije). Izgubo enega ali več elektronov s strani atoma spremlja povečanje oksidacijskega števila elementa kot posledica reakcij. Za OVR, ki teče med ioni močnih elektrolitov v vodnih raztopinah, se pogosteje ne uporablja elektronska tehtnica, ampak metoda polovičnih reakcij.
Morda bi bilo koristno prebrati:
- Dan svetih žena, ki nosijo miro;
- Pasijonosec Jevgenij Botkin Mučenik Jevgenij Botkin;
- Sveti rap: Čuvaški "Okhlobystin" z recitativom uči najstnike ljubezni in ponižnosti;
- Škofijski misijonski tečaji: Predavanje o misijonskem delu protodiakona A;
- Kako razumeti, kaj je všeč škorpijonu;
- Zombi apokalipsa na spletu s prijatelji;
- Igre na spletu igranje zombi apokalipse;
- Težave pri zagonu igre Fifa;