Moddaning massasi harfi. Kimyo. Kimyoviy tenglamalar bo'yicha masalalarni yechish algoritmi
Atrofimizdagi bo'shliq turli xil narsalar bilan to'ldirilgan jismoniy jismlar, ular har xil massaga ega bo'lgan turli moddalardan iborat. Kimyo va fizika bo'yicha maktab kurslari, moddaning massasini topish tushunchasi va usuli bilan tanishtirildi, maktabda o'qigan har bir kishi tomonidan tinglandi va xavfsiz tarzda unutildi. Lekin ayni paytda nazariy bilim, bir marta sotib olingan, eng kutilmaganda kerak bo'lishi mumkin bu daqiqa.
Biroq, umumiy konsensus shundaki, quruq havo 21% kislorod, 78% azot va 1% argondan iborat. Karbonat angidrid, vodorod, geliy, neon, kripton va ksenonni o'z ichiga olgan iz miqdorida mavjud bo'lgan bir qator boshqa gazlar mavjud, ammo bu mashqning maqsadlari uchun biz ularni e'tiborsiz qoldiramiz. Aytaylik, biz quruq havoning molyar massasini topmoqchimiz. Avval har bir gaz uchun nisbiy massa formulasini topamiz.
Bizda azot bor. Argon bir atomli gaz, shuning uchun bizda bor. Shunday qilib, quruq havoning molyar massasi quyidagicha hisoblanadi. Namunadagi moddaning miqdorini toping. Namunadagi moddaning miqdori namunaning massasini moddaning molyar massasiga bo'lish yo'li bilan hisoblanadi. Masalan, bizda o'ttiz gramm kaliy bor, deylik.
- Hajm o'lchovlari - kub santimetr, metr. Ya'ni, 200 litrli bir barrel 2 m³ hajmga ega.
- O'ziga xos tortishish o'lchovi jadvallar yordamida topiladi va har bir modda uchun doimiy qiymatdir. Zichlik kg/m³, g/sm³, t/m³ da o'lchanadi. Lager pivoning zichligi va boshqalar spirtli ichimliklar veb-saytida ko'rish mumkin. 1025,0 kg/m³.
- Zichlik formulasidan p \u003d m / V => m \u003d p * V: m \u003d 1025,0 kg / m³ * 2 m³ \u003d 2050 kg.
To'liq engil pivo bilan to'ldirilgan 200 litrli barrel 2050 kg massaga ega bo'ladi.
i bo'lim. umumiy kimyo
E'tibor bering, gaz namunasi uchun biz odatda massani emas, balki namunaning hajmini olamiz. Yaxshiyamki, bu erda Avogadro qonuni yordamga keladi. Bu qonun shuni ko'rsatadiki, bir xil harorat va bosimdagi barcha gazlarning teng hajmlari bir xil miqdordagi zarralarni o'z ichiga oladi.
Avogadro qonuni, shuningdek, har qanday gazning bir molining hajmi yigirma ikki nuqtaga teng ekanligini aytadi - standart harorat va bosimda har bir mol uchun to'rt litr. Gazlar uchun bizning formulamiz bo'ladi. Aytaylik, biz laboratoriya tajribasida standart harorat va bosimda ikki yuz ellik mililitr karbonat angidridni chiqardik. Bu gazning bizda nechta mol bor?
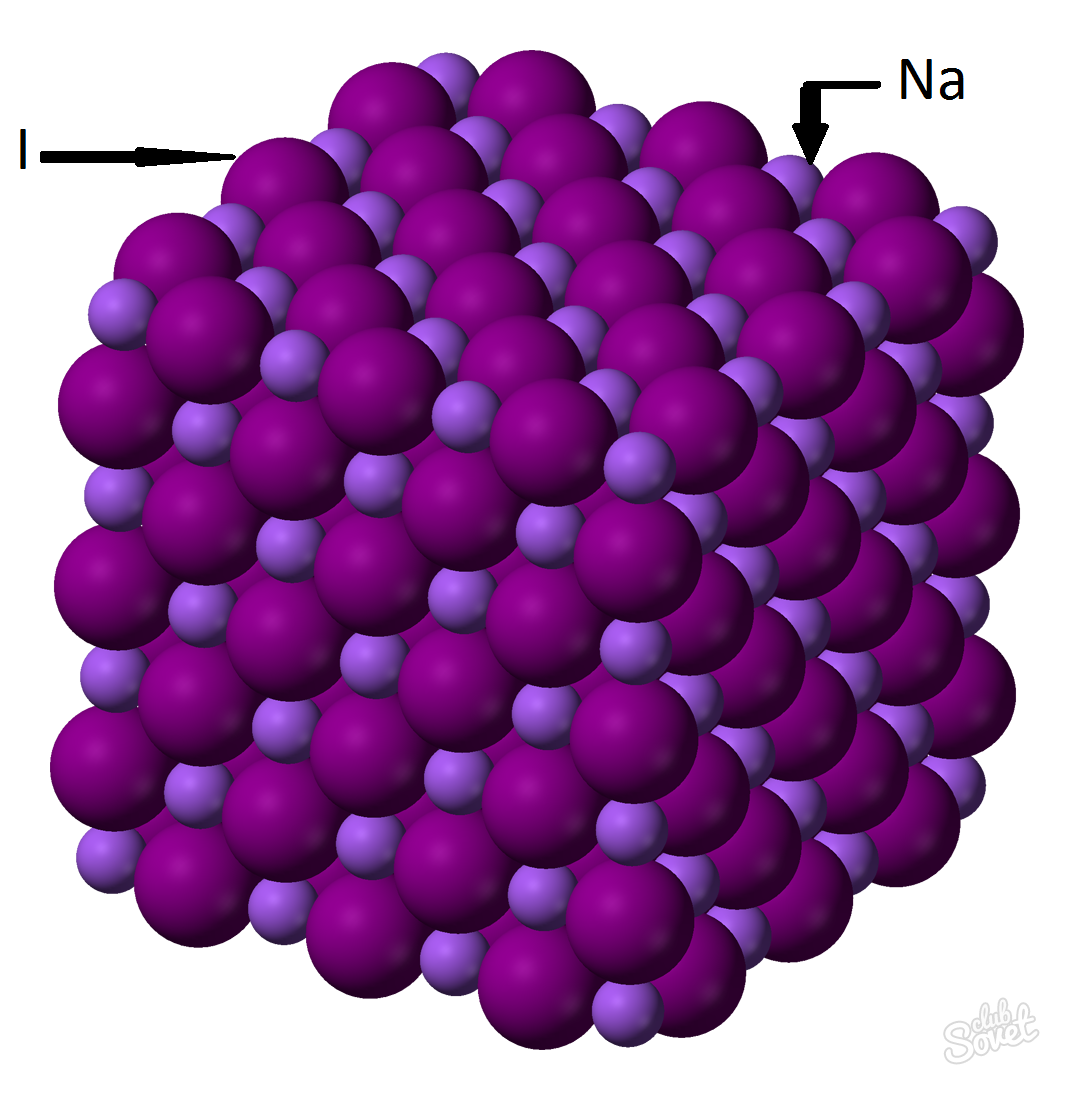
- Molyar massa yagona SI o'lchov tizimida hisoblanadi va kg / mol, g / mol bilan o'lchanadi. Natriy yodidning molyar massasi har bir elementning molyar massalarining yig'indisiga teng: M (NaI)=M (Na)+M (I). Har bir elementning molyar massasining qiymatini jadvaldan hisoblash mumkin yoki siz saytdagi onlayn kalkulyatordan foydalanishingiz mumkin: M (NaI) \u003d M (Na) + M (I) \u003d 23 + 127 \u003d 150 (g / mol).
- Umumiy formuladan M (NaI) \u003d m (NaI) / v (NaI) => m (NaI) \u003d v (NaI) * M (NaI) \u003d 0,6 mol * 150 g / mol \u003d 90 gramm.
Moddaning massa ulushi 0,6 mol bo'lgan natriy yodidning (NaI) massasi 90 grammni tashkil qiladi.
Namuna massasi = Moddaning miqdori × Moddaning molyar massasi. Agar namunadagi moddaning mollari sonini bilsak, moddaning miqdorini moddaning molyar massasiga ko'paytirish orqali namunaning massasini hisoblashimiz mumkin. Masalan, bizda uch yarim mol glyukoza bor deylik.
Namuna hajmi = moddaning miqdori × moddaning molyar hajmi. Agar biz gaz namunasi bilan ishlayotgan bo'lsak, bu odatda talab bo'lishi mumkin, ammo u qattiq yoki suyuqliklarga teng darajada qo'llanilishi mumkin. Agar namunadagi moddaning mol sonini bilsak, moddaning miqdorini moddaning molyar hajmiga ko'paytirish orqali namunaning hajmini hisoblashimiz mumkin. Aytaylik, bizda mol vodorodning sakkizdan bir qismi bor.
- Eritmani suv bilan suyultirish. Erigan X moddaning massasi m (X)=m'(X) o'zgarmaydi. Eritmaning massasi qo'shilgan suv massasiga m '(p) \u003d m (p) + m (H 2 O) ortadi.
- Eritmadan suvning bug'lanishi. X erigan moddaning massasi m (X)=m' (X) o'zgarmaydi. Eritmaning massasi bug'langan suvning massasi m '(p) \u003d m (p) -m (H 2 O) bilan kamayadi.
- Ikkita eritmaning drenajlanishi. Eritmalarning massalari, shuningdek X erigan moddaning massalari aralashtirilganda qo'shiladi: m '' (X) \u003d m (X) + m ' (X). m '' (p) \u003d m (p) + m '(p).
- Kristallarning tushishi. Erigan X moddasi va eritmaning massalari cho'kma kristallarning massasiga kamayadi: m '(X) \u003d m (X) -m (cho'kma), m '(p) \u003d m (p) -m (cho'kma).

Namunadagi elementar ob'ektlar sonini toping. Atomlar va molekulalar kabi elementar ob'ektlarni sanab bo'lmaydigan darajada kichik, ammo Avogadro doimiysi ko'rinishida bir mol moddadagi elementar mavjudotlar soni haqida bizga juda yaxshi baho berildi. Bu bizga moddaning berilgan namunasi uchun bizda mavjud bo'lgan elementar elementlar sonini hisoblash imkonini beradi, agar bizga namunadagi moddaning moldagi miqdori yoki namunaning grammdagi massasi yoki hajmi berilgan bo'lsa. namuna litrda.
Bu bizga namunadagi moddaning mollari soni berilganda formuladir. Keling, uch mol natriyda nechta atom borligini bilib olaylik. Javob bo'lishini unutmang toza raqam- birliklar ishtirok etmaydi. Agar bizga namunaning massasi grammda berilgan bo'lsa, biz bu massani moddaning molyar massasiga bo'lishimiz kerak va natijani Avogadro doimiysiga ko'paytirishimiz kerak.

Moddaning massasini topish variantlari maktabda o'qitishning foydali kursidir, ammo amalda qo'llaniladigan usullar. Har bir inson yuqoridagi formulalarni qo'llash va taklif qilingan jadvallarni qo'llash orqali kerakli moddaning massasini osongina topishi mumkin. Vazifani engillashtirish uchun barcha reaktsiyalarni, ularning koeffitsientlarini yozing.
Faraz qilaylik, biz o'ttiz olti gramm saxarozadagi molekulalar sonini bilmoqchimiz. E'tibor bering, bu holda elementar mavjudot juda murakkab uglevod molekulasidir. Aslida, siz ushbu moddani - shakarning keng tarqalgan shaklini oldingi misolda uchratdingiz.
Gaz namunasidagi elementar ob'ektlar sonini topish tartibi shunga o'xshash, bundan tashqari, namunaning hajmi litrda berilgan bo'lishi mumkin. Gaz namunasi uchun ishlatiladigan gaz turi ahamiyatsiz. Muhimi shundaki, biz to'g'ri molar hajmdan foydalanayotganimizga ishonch hosil qilamiz.
Bunday daftarni saqlash zarurati to'g'risidagi qaror darhol emas, balki asta-sekin, ish tajribasini to'plash bilan keldi.
Dastlab bu ish kitobining oxirida joy edi - eng muhim ta'riflarni yozish uchun bir necha sahifalar. Keyin u erda eng muhim jadvallar joylashtirildi. Keyinchalik, muammolarni hal qilishni o'rganish uchun ko'pchilik talabalarga, birinchi navbatda, tushunishlari va eslab qolishlari kerak bo'lgan qat'iy algoritmik retseptlar kerakligi tushunildi.
Litrdagi namunaning ma'lum hajmi uchun ushbu hajmni moddaning molyar hajmiga, ma'lum bir harorat va bosimdagi bir mol uchun litrga bo'linadi va natijani Avogadro doimiysiga ko'paytiring. Faraz qilaylik, biz besh litr karbonat angidrid namunasidagi karbonat angidrid molekulalari sonini topmoqchimiz. Ushbu misolda biz namunani ushlab turamiz deb taxmin qilamiz xona harorati va bosim. quyida bayon qilinganidek.
Gazning molyar hajmi noma'lum bo'lgan harorat va bosim uchun uni quyidagi standart tenglama yordamida osongina hisoblash mumkin. Gaz konstantasi bilan bog'liq juda chalkash birlik - bu kilovoltga bir mol uchun litr atmosfera. Agar bu siz uchun ayni paytda buni anglatmasa, tashvishlanmang. Biroq, bir nechtasi borligiga e'tibor bering turli xil variantlar gaz doimiy. To'g'ri foydalanish bosim, harorat va hajm birliklariga bog'liq bo'ladi. Bu ko'pincha talabalar va bir nechta o'qituvchilar uchun chalkashlik manbai bo'ladi!
Aynan o'sha paytda ish daftariga qo'shimcha ravishda yana bir majburiy kimyo daftarini - kimyoviy lug'atni saqlash to'g'risida qaror qabul qilindi. Bir o'quv yilida ikkita bo'lishi mumkin bo'lgan ish daftarlaridan farqli o'laroq, lug'at butun kimyo kursi uchun bitta daftardir. Bu daftarda 48 ta varaq va mustahkam muqovali bo'lsa yaxshi bo'ladi.
Barcha materiallarning xususiyatlari va tarkibini, ular sodir bo'lishi mumkin bo'lgan o'zgarishlarni va bunday o'zgarishlarni tartibga soluvchi qonunlarni o'rganadigan fan sohasi. Jismoniy o'zgarish: tana tashqi shaklini o'zgartirganda, lekin uning ichki tarkibi bir xil bo'ladi.
Muzlatilgan suv Quyma stakan Distillash moyi Suv va qum. . Kimyoviy o'zgarish: Bu moddaning ichki tuzilishi o'zgarganda, odatda yonish tufayli boshqa boshqa modda hosil bo'ladi. Ko'ylakni bo'yash. . Fan: Ilmiy usul orqali to'plangan uyushgan bilim.
Biz ushbu daftardagi materialni quyidagicha tartibga solamiz: boshida - bolalar darslikdan yozadigan yoki o'qituvchining diktanti ostida yozadigan eng muhim ta'riflar. Masalan, 8-sinfdagi birinchi darsda bu “kimyo” fanining ta’rifi, “kimyoviy reaksiyalar” tushunchasi. 8-sinfda o'quv yilida ular o'ttizdan ortiq to'planadi. Ushbu ta'riflarga ko'ra, men ba'zi darslarda so'rovnomalar o'tkazaman. Masalan, zanjirdagi og'zaki savol, bir talaba boshqasiga savol berganda, agar u to'g'ri javob bergan bo'lsa, u keyingi savolni allaqachon beradi; yoki bir o'quvchiga boshqa talabalar tomonidan savol berilganda, agar u javobga dosh bermasa, ular o'zlari javob berishadi. Organik kimyoda bular asosan organik moddalar sinflarining ta'riflari va asosiy tushunchalar, masalan, "homologlar", "izomerlar" va boshqalar.
Murakkab: Bir yoki bir nechta elementlarning qat'iy nisbatlarda birikishi natijasida hosil bo'lgan sof moddalar. Diffuziya: gazlarning bir-biri bilan oson aralashish xususiyati. Element: barcha moddiy narsalar yaratilgan asosiy moddalar.
Energiya: ishni bajarish yoki issiqlikni uzatish qobiliyati. Potensial energiya: organizmda mavjud bo'lgan to'plangan energiya kimyoviy tarkibi yoki sizning pozitsiyangiz. Agregatsiya holatlari: tanani qanday topishimiz mumkin. Qat'iy: u shakli va hajmini belgilaydi. Ularning molekulalari bir-biriga yaqin joylashgan.
Ma'lumotnomamiz oxirida materiallar jadval va diagrammalar ko'rinishida keltirilgan. Oxirgi sahifada birinchi jadval "Kimyoviy elementlar. Kimyoviy belgilar". Keyin "Valentlik", "Kislotalar", "Ko'rsatkichlar", "Metallar kuchlanishlarining elektrokimyoviy qatorlari", "Elektromanfiylik seriyalari" jadvallari.
Men, ayniqsa, "Kislotalarning kislota oksidlariga mos kelishi" jadvalining mazmuniga to'xtalib o'tmoqchiman:
U konteyner shaklini oladi. Gazsimon: Ularning aniq shakli yoki hajmi yo'q. qadimgi davr: Birinchi buyuk tsivilizatsiyalar shisha va bo'yoqlar kabi moddalarni birlashtirishni o'rgandilar. Ular 4 ta elementni hamma uchun asos deb hisoblashgan.
Alkimyo: Olimlar oltin yoki hayot eliksirini yaratish uchun moddalarni birlashtirishga o'zlarini bag'ishladilar. Yatrokimyo: Alkimyogarlar murakkab moddalarni topdilar shifobaxsh xususiyatlari. Flogiston: moddalarning tarkibida flogiston borligi va ular yonganda ular uni yo'qotadigan nazariya.
Zamonaviy kimyo: materiyaning saqlanish qonuni yaratilgan Antuan Lavuazyedan boshlanadi. Moddaning saqlanish qonuni: "Materiya yaratilmaydi yoki yo'q qilinmaydi, faqat o'zgaradi". Energiyaning saqlanish qonuni: "Energiya yaratilmaydi yoki yo'q qilinmaydi, balki o'zgaradi".
| Kislotalarning kislota oksidlariga mos kelishi | ||||
| kislota oksidi | Kislota | |||
| Ism | Formula | Ism | Formula | Kislota qoldig'i, valentlik |
| uglerod oksidi (II) | CO2 | ko'mir | H2CO3 | CO 3 (II) |
| oltingugurt (IV) oksidi | SO2 | oltingugurtli | H2SO3 | SO3(II) |
| oltingugurt (VI) oksidi | SO 3 | oltingugurt | H2SO4 | SO4(II) |
| kremniy (IV) oksidi | SiO2 | kremniy | H2SiO3 | SiO 3 (II) |
| azot oksidi (V) | N 2 O 5 | azotli | HNO3 | NO 3 (I) |
| fosfor (V) oksidi | P2O5 | fosforli | H3PO4 | PO 4 (III) |
Ushbu jadvalni tushunmasdan va yodlamasdan, 8-sinf o'quvchilari uchun kislota oksidlarining ishqorlar bilan reaktsiyalari uchun tenglamalarni tuzish qiyin.
Elektrolitik dissotsilanish nazariyasini o'rganayotganda, daftar oxirida biz sxemalar va qoidalarni yozamiz.
Ion tenglamalarini tuzish qoidalari:
1. Ion shaklida suvda eriydigan kuchli elektrolitlar formulalarini yozing.
Massa: tanadagi moddalar miqdori. Mavzu: Bu koinotda amalga oshiriladigan narsa. ilmiy usul: o'tkazish tartibi ilmiy tadqiqot. Muammoni aniqlang va tuzing. Muammo haqida ma'lumot to'plang. Ma'lumotlarni tahlil qiling va mumkin bo'lgan echimlarni taklif qiling.
Reja tuzing yoki tajribalar qiling. Natijalarni baholang. Aralashma: o'zgaruvchan tarkibdagi ikki yoki undan ortiq moddalarning tarkibi. Heterojen aralashma: bir hil xususiyatlarni o'z ichiga olmaydi, uning tarkibiy qismlarini yalang'och ko'z bilan farqlash mumkin. Bir hil aralashma: moddalar birikmasi bilan bir hil tarkib.
2. Molekulyar shaklda oddiy moddalar, oksidlar, kuchsiz elektrolitlar va barcha erimaydigan moddalar formulalarini yozing.
3. Tenglamaning chap tomonida yomon eriydigan moddalar formulalari ion shaklida, o'ng tomonida molekulyar shaklda yoziladi.
Organik kimyoni o'rganayotganda lug'atga uglevodorodlar, kislorod va azot o'z ichiga olgan moddalar sinflari, genetik munosabatlar sxemalari uchun umumlashtiruvchi jadvallarni yozamiz.
Aralashuvchanlik: bir hil aralashtirilgan suyuqliklarning xossalari. Og'irligi: Bu bir tananing boshqasiga tortishish kuchi. Organik: uglerodli moddalarni o'rganish. Noorganik moddalar: tarkibida uglerod bo'lmagan moddalarni o'rganish. Analitik: moddaning tarkibini o'rganish.
Biokimyo: tadqiqot kimyoviy reaksiyalar tirik organizmlar. Yechim: Bu bir hil aralashma, bir xil tarkibga ega va tashqi ko'rinish. Sof modda: butunlay moddalarning bir sinfidan tashkil topgan individual kimyoviy modda. Yopishqoqlik: Suyuqlik qarshiligi oqishi oson.
| Fizik miqdorlar | |||
| Belgilanish | Ism | Birliklar | Formulalar |
| moddaning miqdori | mol | = N / N A; = m / M; V / V m (gazlar uchun) |
|
| N A | Avogadro doimiysi | molekulalar, atomlar va boshqa zarralar | N A = 6,02 10 23 |
| N | zarrachalar soni | molekulalar, atomlar va boshqa zarralar |
N = N A |
| M | molyar massa | g/mol, kg/kmol | M = m /; / M/ = M r |
| m | vazn | g, kg | m = M; m = V |
| Vm | gazning molyar hajmi | l / mol, m 3 / kmol | Vm \u003d 22,4 l / mol \u003d 22,4 m 3 / kmol |
| V | hajmi | l, m 3 | V = V m (gazlar uchun); |
| zichlik | g/ml; | = m/V; M / V m (gazlar uchun) Proton: musbat zaryadga ega bo'lgan va atom yadrosining bir qismi bo'lgan subatomik zarracha. Neytron: yadroda proton yonida joylashgan elektr neytral zarracha. Elektron: atomni o'rab turgan bo'shliqni egallagan manfiy zaryadlangan zarracha. Massa yoki atom og'irligi: Atom atomlarining o'rtacha og'irlikdagi massasi. Bu protonlar va elektronlar yig'indisidir. U A harfi bilan ifodalanadi. Atom raqami: Atomdagi protonlar soni. Izotop: Har xil miqdordagi neytronlarga ega bo'lgan ma'lum bir elementning atomlari. Anionlar: manfiy zaryadli ion. |
|
25 uchun - yozgi davr maktabda kimyodan dars berar ekanman, turli dastur va darsliklar bo‘yicha ishlashga majbur bo‘ldim. Shu bilan birga, deyarli hech qanday darslik muammolarni qanday hal qilishni o'rgatilmagani har doim hayratlanarli edi. Kimyo fanini o‘rganishning boshida lug‘atdagi bilimlarni tizimlashtirish va mustahkamlash maqsadida men va talabalar “Fizikaviy miqdorlar” jadvalini yangi miqdorlar bilan tuzamiz:
Kationlar: musbat zaryadlangan ionlar. Barcha elementlar "atom" deb ataladigan mayda, bo'linmas zarrachalardan iborat bo'lib, ularni yo'q qilib bo'lmaydi. Elementning barcha atomlari bir xil. Ruxsat etilgan nisbatlarda aralashtirilgan elementlarning barcha atomlari birikmalar hosil qiladi.
Kimyoviy reaktsiya o'zgarishlarni o'z ichiga oladi. Doimiy tarkib qonuni. Murakkab har doim ma'lum nisbatlarda elementlarni o'z ichiga oladi va boshqa kombinatsiyalarda bo'lmaydi. U ma'lum nisbatlar qonuni deb ham ataladi. Buni Jozef Prust e'lon qilgan.
Agar ikkita element bir nechta birikma hosil qilsa, ikkinchi elementning qattiq massasida birlashadigan elementlarning turli massalari butun sonlarning bir qismiga ega. Molekulyar og'irligi: yig'indisi atom massalari molekulani tashkil etuvchi har bir atom. Avogadro soni: moldagi zarrachalar soni.
Talabalarga hisoblash masalalarini yechishni o'rgatishda, katta ahamiyatga ega Men algoritmlarni beraman. Ishonamanki, harakatlar ketma-ketligini qat'iy belgilab qo'yish zaif o'quvchiga ma'lum bir turdagi muammolarni hal qilishni tushunishga imkon beradi. Kuchli talabalar uchun bu ularning keyingi kimyoviy ta'lim va o'z-o'zini o'qitishning ijodiy darajasiga erishish imkoniyatidir, chunki avval siz nisbatan kam miqdordagi standart texnikani ishonchli o'zlashtirishingiz kerak. Buning asosida murakkabroq masalalarni echishning turli bosqichlarida ularni to'g'ri qo'llash qobiliyati rivojlanadi. Shuning uchun men maktab darslarining barcha turlari va sinfdan tashqari mashg'ulotlar uchun hisoblash masalalarini echish algoritmlarini tuzdim.
Masalan: bir mol birikma molekulasini tashkil etuvchi har bir atomning atom massalari yig'indisiga teng. Bu raqam ushbu birikmaning bir moliga teng bo'ladi. Birinchidan, mutanosiblik qoidasi bajariladi. Birinchidan, molekulyar og'irlik hisoblab chiqiladi. Atomlarning elektronlari energiya darajasida yoki qatlamlarda bo'lib, atom yadrosidan masofa oshgani sayin energiya ko'payadi. Shuning uchun elektron atom markaziga qanchalik yaqin bo'lsa, uning energiyasi shunchalik past bo'ladi. Bu kvant raqamlari butun sonlar yoki harflar bilan belgilanadi.
Asosiy kvant soni orbitaning energiyasini aniqlaydi. Atomning oxirgi energiya darajasini to'ldiradigan elektronlar valent elektronlar deb nomlanadi. Ruxsat berilishi mumkin bo'lgan elektronlarning maksimal soni oxirgi daraja, valentlik elektronlarining maksimal soniga ega bo'lgan vodorod va geliy atomlaridan tashqari sakkizta elektrondir.
Men ulardan ba'zilariga misollar keltiraman.
Kimyoviy tenglamalar bo'yicha masalalarni yechish algoritmi.
1. Masala shartini qisqacha yozing va kimyoviy tenglama tuzing.
2. Kimyoviy tenglamadagi formulalar ustiga masala ma’lumotlarini yozing, formulalar ostidagi mollar sonini yozing (koeffitsient bilan aniqlanadi).
3. Massasi yoki hajmi masala shartida berilgan moddaning miqdorini formulalar yordamida toping:
M/M; \u003d V / V m (gazlar uchun V m \u003d 22,4 l / mol).
Olingan sonni tenglamadagi formula ustiga yozing.
4. Massasi yoki hajmi noma’lum moddaning miqdorini toping. Buning uchun tenglama bo'yicha fikr yuriting: shartga ko'ra mollar sonini tenglama bo'yicha mollar soni bilan solishtiring. Agar kerak bo'lsa, nisbat.
5. Formulalar yordamida massa yoki hajmni toping: m = M ; V = V m.
Bu algoritm talabaning o‘zlashtirishi kerak bo‘lgan asos bo‘lib, kelajakda u turli murakkablikdagi tenglamalar yordamida masalalarni yecha oladi.
Ortiqcha va kamchilik uchun vazifalar.
Agar muammoning holatida ikkita reaksiyaga kirishuvchi moddalarning miqdori, massasi yoki hajmi bir vaqtning o'zida ma'lum bo'lsa, bu ortiqcha va etishmovchilik muammosidir.
Uni hal qilishda:
1. Ikki reaksiyaga kirishuvchi moddaning miqdorini formulalar bo'yicha topish kerak:
M/M; = V/V m.
2. Olingan mol raqamlari tenglamaning tepasiga yozilgan. Tenglama bo'yicha ularni mollar soni bilan taqqoslab, qaysi moddaning etishmasligi haqida xulosa chiqaring.
3. Kamchilik bo'yicha qo'shimcha hisob-kitoblarni amalga oshiring.
Nazariy jihatdan mumkin bo'lgan amaliy jihatdan olingan reaktsiya mahsulotining hosildorligi ulushi bo'yicha vazifalar.
Reaksiya tenglamalariga ko'ra, nazariy hisob-kitoblar olib boriladi va reaksiya mahsuloti uchun nazariy ma'lumotlar topiladi: nazariya. , m nazariyasi. yoki V nazariyasi. . Laboratoriyada yoki sanoatda reaktsiyalarni o'tkazishda yo'qotishlar yuzaga keladi, shuning uchun olingan amaliy ma'lumotlar amaliydir. ,
m amaliy yoki V amaliy. har doim nazariy jihatdan hisoblangan ma'lumotlardan kamroq bo'ladi. Hosildorlik ulushi (eta) harfi bilan belgilanadi va quyidagi formulalar bilan hisoblanadi:
(bu) = amaliyot. / nazariya. = m amaliy. / m nazariyasi. = V amaliy. / V nazariyasi.
U birlikning ulushi yoki foiz sifatida ifodalanadi. Vazifalarning uch turi mavjud:
Agar muammoning holatida boshlang'ich moddaning ma'lumotlari va reaktsiya mahsulotining unumining ulushi ma'lum bo'lsa, unda siz amaliy narsani topishingiz kerak. , m amaliy yoki V amaliy. reaktsiya mahsuloti.
Yechim tartibi:
1. Asl modda uchun ma'lumotlarga asoslanib, tenglama bo'yicha hisoblang, nazariyani toping. , m nazariyasi. yoki V nazariyasi. reaktsiya mahsuloti;
2. Reaksiya mahsulotining amalda olingan massasi yoki hajmini formulalar bo‘yicha toping:
m amaliy = m nazariyasi. ; V mashq. = V nazariyasi. ; amaliy = nazariya. .
Agar muammoning holatida boshlang'ich modda va amaliyot uchun ma'lumotlar ma'lum bo'lsa. , m amaliy yoki V amaliy. olingan mahsulotning, shu bilan birga reaksiya mahsuloti unumining ulushini topish kerak.
Yechim tartibi:
1. Boshlang'ich modda uchun ma'lumotlarga asoslanib, tenglama bo'yicha hisoblang, toping
Teor. , m nazariyasi. yoki V nazariyasi. reaktsiya mahsuloti.
2. Reaksiya mahsuloti unumining ulushini formulalar yordamida toping:
Amaliyot. / nazariya. = m amaliy. / m nazariyasi. = V amaliy. /V nazariyasi.
Agar muammoning holati ma'lum bo'lsa, amaliyot. , m amaliy yoki V amaliy. hosil bo'lgan reaktsiya mahsuloti va uning hosilining ulushi, bu holda siz boshlang'ich modda uchun ma'lumotlarni topishingiz kerak.
Yechim tartibi:
1. Teoriyani toping., m teor. yoki V nazariyasi. formulalar bo'yicha reaktsiya mahsuloti:
Teor. = amaliy / ; m nazariyasi. = m amaliy. / ; V nazariyasi. = V amaliy. / .
2. Nazariyaga asoslanib, tenglama bo‘yicha hisoblang. , m nazariyasi. yoki V nazariyasi. reaktsiya mahsuloti va boshlang'ich material uchun ma'lumotlarni toping.
Albatta, biz bu uch turdagi masalalarni bosqichma-bosqich ko'rib chiqamiz, bir qator masalalar misolida ularning har birini yechish ko'nikmalarini ishlab chiqamiz.
Aralashmalar va aralashmalar bilan bog'liq muammolar.
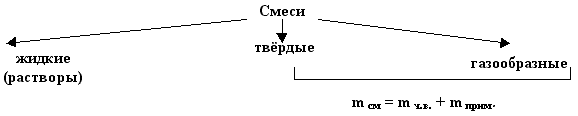
Sof modda - bu aralashmada ko'proq bo'lgan narsa, qolganlari aralashmalardir. Belgilar: aralashmaning massasi - m sm, toza moddaning massasi - m q.v., aralashmalar massasi - m ga yaqin. , sof moddaning massa ulushi - h.v.
Sof moddaning massa ulushi quyidagi formula bo'yicha topiladi: h.v. = m q.v. / m qarang, uni birlikning kasrlarida yoki foizda ifodalang. Biz 2 turdagi vazifalarni ajratamiz.
Agar masala shartida sof moddaning massa ulushi yoki aralashmalarning massa ulushi berilsa, aralashmaning massasi beriladi. "Texnik" so'zi aralashmaning mavjudligini ham anglatadi.
Yechim tartibi:
1. Sof moddaning massasini quyidagi formula yordamida toping: m p.m. = q.v. ko'raman.
Agar aralashmalarning massa ulushi berilgan bo'lsa, avval siz toza moddaning massa ulushini topishingiz kerak: = 1 - taxminan.
2. Sof moddaning massasiga asoslanib, tenglamaga asosan keyingi hisob-kitoblarni bajaring.
Agar masala sharti dastlabki aralashmaning massasini va reaksiya mahsulotining n, m yoki V ni keltirsa, u holda dastlabki aralashmadagi sof moddaning massa ulushini yoki undagi aralashmalarning massa ulushini topish kerak.
Yechim tartibi:
1. Reaksiya mahsuloti uchun ma’lumotlarga asoslanib, tenglama bo‘yicha hisoblang va n soatni toping. va m h.v.
2. Aralashmadagi sof moddaning massa ulushini quyidagi formula yordamida toping: q.v. = m q.v. / m qarang va aralashmalarning massa ulushi: taxminan. = 1 - h.c.
Gazlarning hajm nisbatlari qonuni.
Gazlarning hajmlari ularning moddalar miqdori bilan bir xil bog'liq:
V 1 / V 2 = 1/2
Bu qonun gazning hajmi berilgan va boshqa gazning hajmini topish kerak bo'lgan tenglamalar bo'yicha masalalarni yechishda qo'llaniladi.
Aralashmadagi gazning hajm ulushi.
Vg / Vcm, bu erda (phi) - gazning hajm ulushi.
Vg - gazning hajmi, Vsm - gazlar aralashmasining hajmi.
Agar masala shartida gazning hajm ulushi va aralashmaning hajmi berilgan bo'lsa, u holda birinchi navbatda gaz hajmini topish kerak: Vg = Vsm.
Gazlar aralashmasining hajmi quyidagi formula bo'yicha topiladi: Vcm \u003d Vg /.
Moddani yoqish uchun sarflangan havo hajmi tenglama bo'yicha topilgan kislorod hajmi orqali topiladi:
Vair \u003d V (O 2) / 0,21
Organik moddalar formulalarini umumiy formulalar bo'yicha chiqarish.
Organik moddalar umumiy formulalarga ega gomologik qatorlarni hosil qiladi. Bu quyidagilarga imkon beradi:
1. Nisbiy molekulyar massani n soni bilan ifodalang.
M r (C n H 2n + 2) = 12n + 1 (2n + 2) = 14n + 2.
2. n bilan ifodalangan M r ni haqiqiy M r ga tenglashtiring va n ni toping.
3. dagi reaksiya tenglamalarini tuzing umumiy ko'rinish va ular bo'yicha hisob-kitoblarni bajaring.
Yonish mahsulotlari bo'yicha moddalar formulalarini olish.
1. Yonish mahsulotlarining tarkibini tahlil qiling va kuygan moddaning sifat tarkibi haqida xulosa chiqaring: H 2 O -> H, CO 2 -> C, SO 2 -> S, P 2 O 5 -> P, Na. 2 CO 3 -> Na, C.
Moddada kislorod mavjudligi tekshirishni talab qiladi. Formuladagi indekslarni x, y, z deb belgilang. Masalan, CxHyOz (?).
2. Formulalar yordamida yonish mahsulotlarining moddalar miqdorini toping:
n = m / M va n = V / Vm.
3. Kuygan modda tarkibidagi elementlarning miqdorini toping. Masalan:
Raqamlarni eng kichigiga bo'lish orqali butun sonlarga aylantiring.
Haqiqiy formulani yozing.
Elementlarning massa ulushlari bo'yicha moddalar formulalarini chiqarish.
1. Indekslarni x, y, z orqali belgilovchi formulani yozing.
2. Indeks nisbatini toping, buning uchun har bir elementning massa ulushini atom massasiga bo'ling: x: y: z = 1 / Ar 1: 2 / Ar 2: 3 / Ar 3.
3. Olingan sonlarni ularning eng kichigiga bo‘lish orqali butun songa keltiring. Agar kerak bo'lsa, bo'lingandan keyin 2, 3, 4, 5 ga ko'paytiriladi.
Yechishning bu usuli eng oddiy formulani aniqlang. Aksariyat noorganik moddalar uchun u haqiqiy bilan mos keladi, organik moddalar uchun, aksincha.
Agar moddaning molyar massasini topish uchun ma'lumotlar ma'lum bo'lsa, elementlarning massa ulushlari bo'yicha moddalar formulalarini chiqarish.
Formulalar yordamida moddaning molyar massasini toping:
a) gazning zichligi ma'lum bo'lsa: M = Vm = g / l 22,4 l / mol; r = m / V.
b) nisbiy zichlik ma'lum bo'lsa: M 1 = D 2 M 2, M = D H2 2, M = D O2 32,
M = D havo. 29, M = D N2 28 va boshqalar.
1 usul: moddaning eng oddiy formulasini (oldingi algoritmga qarang) va eng oddiy molyar massasini toping. Keyin haqiqiy molyar massani eng oddiy bilan solishtiring va formuladagi indekslarni kerakli miqdordagi marta oshiring.
2 yo'l: n = (e) Mr / Ar (e) formulasidan foydalanib indekslarni toping.
Agar elementlardan birining massa ulushi noma'lum bo'lsa, uni topish kerak. Buning uchun boshqa elementning massa ulushini 100% yoki birlikdan ayirish kerak.
Asta-sekin, kimyoviy lug'atda kimyoni o'rganish jarayonida muammolarni hal qilish algoritmlari to'planadi. turli xil turlari. Va talaba har doim muammoni hal qilish uchun kerakli formulani yoki kerakli ma'lumotni qaerdan topishni biladi.
Ko'pgina talabalar bunday daftarni saqlashni yaxshi ko'radilar, ular o'zlari uni turli xil ma'lumotnomalar bilan to'ldiradilar.
Sinfdan tashqari mashg'ulotlarga kelsak, talabalar va men ham chegaradan tashqariga chiqadigan muammolarni hal qilish algoritmlarini yozish uchun alohida daftarni boshlaymiz. maktab o'quv dasturi. Xuddi shu daftarda har bir turdagi topshiriq uchun biz 1-2 ta misol yozamiz, ular qolgan topshiriqlarni boshqa daftarda hal qilishadi. Va agar siz o'ylab ko'rsangiz, barcha universitetlarda kimyo bo'yicha imtihonda uchraydigan minglab turli xil vazifalar orasida 25-30 xil turdagi vazifalarni ajratib ko'rsatish mumkin. Albatta, ular orasida juda ko'p farqlar mavjud.
Fakultativ darslarda masalalarni yechish algoritmlarini ishlab chiqishda A.A. Kushnarev. (Kimyodan masalalar yechishni o'rganish, - M., Maktab - matbuot, 1996).
Kimyo fanidan masalalar yechish qobiliyati fanni ijodiy o‘zlashtirishning asosiy mezoni hisoblanadi. Aynan turli darajadagi murakkablikdagi masalalarni yechish orqali kimyo kursini samarali o‘zlashtirish mumkin.
Agar talaba barcha mumkin bo'lgan vazifalar turlari haqida aniq tasavvurga ega bo'lsa, har bir turdagi ko'p sonli vazifalarni hal qilgan bo'lsa, u Yagona davlat imtihonlari shaklida kimyo fanidan imtihon topshirishga va universitetlarga kirishga qodir. .
O'qish foydali bo'lishi mumkin:
- Homiladorlikning 17-haftasida o'zini qanday his qiladi?;
- Homiladorlik davrida spazmalgonni ikkinchi trimestrda qo'llash oqlanadimi?;
- Homiladorlikning to'rtinchi haftasi: belgilar, alomatlar, fotosurat, ultratovush;
- Homilador ayollar "Stodal" yo'tali mumkinmi;
- Bolalarda faringitning belgilari va davolash: pediatr maslahati 7 oylik chaqaloqlarda o'tkir faringit;
- Bu "dahshatli" gemoglobin;
- Mixail Sergeevich Gorbachev qayerdan?;
- Sog'lik va vazn yo'qotish uchun ro'za kunlarini qanday o'tkazish kerak O'zingiz uchun ro'za kunlarini qanday qilib to'g'ri tashkil qilish kerak;