მატერიის მასის წერილი. Ქიმია. ქიმიური განტოლებებით ამოცანების ამოხსნის ალგორითმი
ჩვენს ირგვლივ სივრცე ივსება განსხვავებული ფიზიკური სხეულები, რომლებიც შედგება სხვადასხვა მასის სხვადასხვა ნივთიერებებისგან. ქიმიისა და ფიზიკის სასკოლო კურსები, რომლებიც წარმოადგენდნენ ნივთიერების მასის პოვნის კონცეფციას და მეთოდს, მოისმინეს და უსაფრთხოდ დაივიწყეს ყველა, ვინც სკოლაში სწავლობდა. მაგრამ ამასობაში თეორიული ცოდნაერთხელ შეძენილი, შეიძლება საჭირო გახდეს ყველაზე მოულოდნელად ამ მომენტში.
თუმცა, საერთო კონსენსუსი არის ის, რომ მშრალი ჰაერი შედგება 21% ჟანგბადისგან, 78% აზოტისა და 1% არგონისგან. არსებობს მრავალი სხვა აირი, რომლებიც წარმოდგენილია კვალი რაოდენობით, მათ შორის ნახშირორჟანგი, წყალბადი, ჰელიუმი, ნეონი, კრიპტონი და ქსენონი, მაგრამ ამ ვარჯიშის მიზნებისთვის ჩვენ მათ უგულებელყოფთ. დავუშვათ, გვინდა ვიპოვოთ მშრალი ჰაერის მოლური მასა. პირველ რიგში, ჩვენ ვიპოვით ფარდობითი მასის ფორმულას თითოეული გაზისთვის.
აზოტისთვის გვაქვს. არგონი არის ერთატომური გაზი, ასე რომ, ჩვენ გვაქვს. ამრიგად, მშრალი ჰაერის მოლური მასა გამოითვლება შემდეგნაირად. იპოვეთ ნივთიერების რაოდენობა ნიმუშში. ნივთიერების რაოდენობა ნიმუშში გამოითვლება ნიმუშის მასის ნივთიერების მოლურ მასაზე გაყოფით. მაგალითად, ვთქვათ, გვაქვს 30 გრამი კალიუმი.
- მოცულობის ზომები - კუბური სანტიმეტრი, მეტრი. ანუ 200 ლიტრიანი ლულის მოცულობა 2 მ³ა.
- სპეციფიკური სიმძიმის საზომი ნაპოვნია ცხრილების გამოყენებით და არის მუდმივი მნიშვნელობა თითოეული ნივთიერებისთვის. სიმკვრივე იზომება კგ/მ³, გ/სმ³, ტ/მ³. ლაგერის ლუდის სიმკვრივე და სხვა ალკოჰოლური სასმელებინახვა შესაძლებელია ვებგვერდზე. ეს არის 1025.0 კგ/მ³.
- სიმკვრივის ფორმულიდან p \u003d m / V => m \u003d p * V: m \u003d 1025.0 კგ / მ³ * 2 მ³ \u003d 2050 კგ.
მსუბუქი ლუდით მთლიანად სავსე 200 ლიტრიანი კასრის მასა 2050 კგ იქნება.
სექცია ი. ზოგადი ქიმია
გაითვალისწინეთ, რომ გაზის ნიმუშისთვის ჩვენ ჩვეულებრივ ვიღებთ ნიმუშის მოცულობას და არა მასას. საბედნიეროდ, აქ ავოგადროს კანონი შველის. ეს კანონი ამბობს, რომ ყველა აირის თანაბარი მოცულობა ერთსა და იმავე ტემპერატურაზე და წნევაზე შეიცავს ნაწილაკების ერთსა და იმავე რაოდენობას.
ავოგადროს კანონი ასევე გვეუბნება, რომ ნებისმიერი გაზის ერთი მოლის მოცულობა არის ოცდაორი წერტილი - ოთხი ლიტრი თითო მოლზე სტანდარტულ ტემპერატურასა და წნევაზე. გაზებისთვის, ჩვენი ფორმულა გახდება. დავუშვათ, რომ ლაბორატორიულ ექსპერიმენტში ახლახან გამოვუშვით ორას ორმოცდაათი მილილიტრი ნახშირორჟანგი სტანდარტულ ტემპერატურასა და წნევაზე. რამდენი მოლი გვაქვს ეს გაზი?
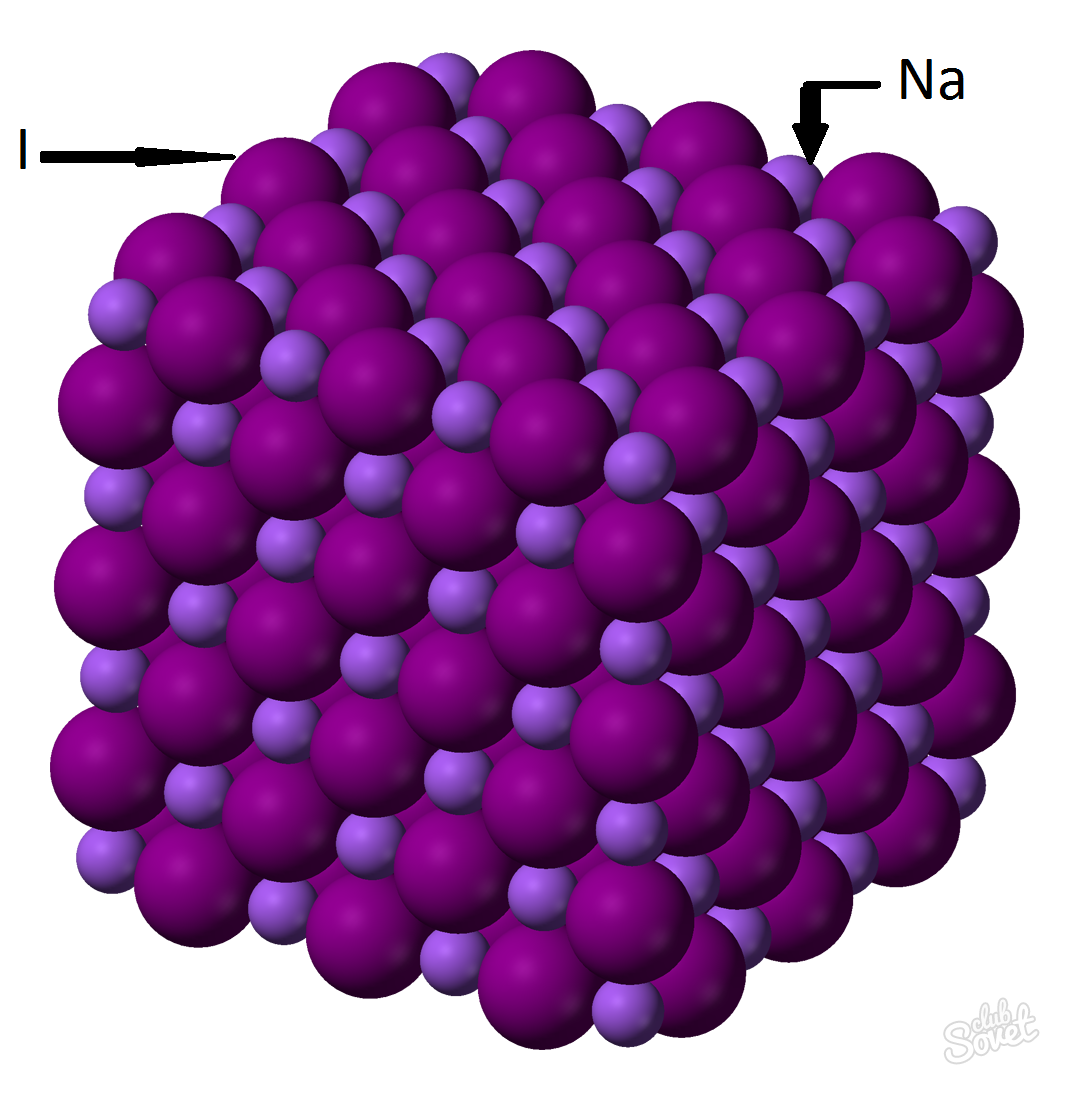
- მოლური მასა გამოითვლება ერთიან SI საზომ სისტემაში და იზომება კგ/მოლში, გ/მოლში. ნატრიუმის იოდიდის მოლური მასა არის თითოეული ელემენტის მოლური მასების ჯამი: M (NaI)=M (Na)+M (I). თითოეული ელემენტის მოლური მასის მნიშვნელობა შეიძლება გამოითვალოს ცხრილიდან, ან შეგიძლიათ გამოიყენოთ ონლაინ კალკულატორი საიტზე: M (NaI) \u003d M (Na) + M (I) \u003d 23 + 127 \u003d 150 (გ/მოლი).
- ზოგადი ფორმულიდან M (NaI) \u003d m (NaI) / v (NaI) => m (NaI) \u003d v (NaI) * M (NaI) \u003d 0,6 მოლი * 150 გ / მოლი \u003d 90 გრამი.
ნატრიუმის იოდიდის (NaI) მასა ნივთიერების მასური წილადით 0,6 მოლი არის 90 გრამი.
ნიმუშის მასა = ნივთიერების რაოდენობა × ნივთიერების მოლური მასა. თუ ჩვენ ვიცით ნივთიერების მოლების რაოდენობა ნიმუშში, შეგვიძლია გამოვთვალოთ ნიმუშის მასა ნივთიერების ოდენობის ნივთიერების მოლარულ მასაზე გამრავლებით. მაგალითად, დავუშვათ, რომ გვაქვს სამნახევარი მოლი გლუკოზა.
ნიმუშის მოცულობა = ნივთიერების რაოდენობა × ნივთიერების მოლარული მოცულობა. ეს, როგორც წესი, დიდი ალბათობით მოთხოვნაა, თუ საქმე გვაქვს აირის ნიმუშთან, მაგრამ ის შეიძლება თანაბრად გავრცელდეს მყარ და სითხეებზე. თუ ჩვენ ვიცით ნივთიერების მოლების რაოდენობა ნიმუშში, შეგვიძლია გამოვთვალოთ ნიმუშის მოცულობა ნივთიერების ოდენობის ნივთიერების მოლარულ მოცულობაზე გამრავლებით. ვთქვათ, გვაქვს წყალბადის მოლის ერთი მერვედი.
- ხსნარის განზავება წყლით. გახსნილი X ნივთიერების მასა არ იცვლება m (X)=m'(X). ხსნარის მასა იზრდება დამატებული წყლის მასით m'(p) \u003d m (p) + m (H 2 O).
- წყლის აორთქლება ხსნარიდან. X გამხსნელის მასა არ იცვლება m (X)=m' (X). ხსნარის მასა მცირდება აორთქლებული წყლის მასით m'(p) \u003d m (p) -m (H 2 O).
- ორი ხსნარის დრენაჟი. ხსნარების მასები, ისევე როგორც გამხსნელი X-ის მასები, შერევისას ემატება: m '' (X) \u003d m (X) + m' (X). m '' (p) \u003d m (p) + m '(p).
- კრისტალების ვარდნა. გახსნილი ნივთიერების X და ხსნარის მასები მცირდება ნალექის კრისტალების მასით: m'(X) \u003d m (X) -m (ნალექი), m'(p) \u003d m (p) -m (დააჩქაროს).

იპოვეთ ელემენტარული ობიექტების რაოდენობა ნიმუშში. ელემენტარული ერთეულები, როგორიცაა ატომები და მოლეკულები, აშკარად ზედმეტად მცირეა დასათვლელად, მაგრამ ჩვენ მივიღეთ საკმაოდ კარგი შეფასება, ავოგადროს მუდმივის სახით, ელემენტარული ერთეულების რაოდენობის შესახებ მატერიის მოლში. ეს საშუალებას გვაძლევს გამოვთვალოთ ელემენტარული ელემენტების რაოდენობა, რაც გვაქვს ნივთიერების მოცემულ ნიმუშზე, იმ პირობით, რომ მოცემული იქნება ნივთიერების რაოდენობა ნიმუშში მოლში, ან ნიმუშის მასა გრამებში, ან მოცულობა. ნიმუში ლიტრებში.
ეს არის ფორმულა, როდესაც მოცემულია ნივთიერების მოლების რაოდენობა ნიმუშში. მოდით გავარკვიოთ რამდენი ატომია ნატრიუმის სამ მოლში. გახსოვდეთ, რომ პასუხი იქნება სუფთა რიცხვი- ერთეული არ არის ჩართული. თუ ნიმუშის მასას გრამებში გვაძლევენ, ეს მასა უნდა გავყოთ ნივთიერების მოლარულ მასაზე და შემდეგ გავამრავლოთ შედეგი ავოგადროს მუდმივზე.

ნივთიერების მასის პოვნის ვარიანტები სასკოლო სწავლების სასარგებლო კურსია, მაგრამ პრაქტიკაში საკმაოდ გამოსაყენებელი მეთოდები. ყველას შეუძლია ადვილად იპოვნოს საჭირო ნივთიერების მასა ზემოაღნიშნული ფორმულების გამოყენებით და შემოთავაზებული ცხრილების გამოყენებით. დავალების გასაადვილებლად ჩაწერეთ ყველა რეაქცია, მათი კოეფიციენტები.
დავუშვათ, გვინდა ვიცოდეთ მოლეკულების რაოდენობა ოცდათექვსმეტ გრამ საქაროზაში. გაითვალისწინეთ, რომ ელემენტარული ერთეული ამ შემთხვევაში საკმაოდ რთული ნახშირწყლების მოლეკულაა. სინამდვილეში, თქვენ უკვე შეხვდით ამ ნივთიერებას - შაქრის საერთო ფორმას - წინა მაგალითში.
გაზის ნიმუშში ელემენტარული ობიექტების რაოდენობის პოვნის პროცედურა მსგავსია, გარდა იმისა, რომ ალბათ მოგვცემენ ნიმუშის მოცულობას ლიტრებში. ნიმუშის გაზისთვის გამოყენებული გაზის ტიპი შეუსაბამოა. მთავარია, დავრწმუნდეთ, რომ ვიყენებთ სწორ მოლარულ მოცულობას.
ასეთი ნოუთბუქის შენახვის გადაწყვეტილება მყისიერად კი არ მოვიდა, არამედ თანდათანობით, სამუშაო გამოცდილების დაგროვებით.
თავიდან ეს იყო ადგილი სამუშაო წიგნის ბოლოს - რამდენიმე გვერდი ყველაზე მნიშვნელოვანი განმარტებების ჩასაწერად. შემდეგ იქ ყველაზე მნიშვნელოვანი მაგიდები განთავსდა. შემდეგ მივხვდი, რომ იმისათვის, რომ ისწავლონ პრობლემების გადაჭრა, სტუდენტების უმეტესობას სჭირდება მკაცრი ალგორითმული რეცეპტები, რაც მათ, პირველ რიგში, უნდა ესმოდეთ და დაიმახსოვროთ.
ნიმუშის მოცემული მოცულობისთვის ლიტრებში, ეს მოცულობა გავყოთ ნივთიერების მოლარულ მოცულობაზე, ლიტრებში თითო მოლზე მოცემულ ტემპერატურასა და წნევაზე და შემდეგ გავამრავლოთ შედეგი ავოგადროს მუდმივზე. დავუშვათ, გვინდა ვიპოვოთ ნახშირორჟანგის მოლეკულების რაოდენობა ხუთი ლიტრი ნახშირორჟანგის ნიმუშში. ამ მაგალითში, ჩვენ ვივარაუდებთ, რომ ნიმუში ინახება ოთახის ტემპერატურაზედა წნევა. შემდეგი გზით.
ტემპერატურისა და წნევისთვის, რომლებისთვისაც გაზის მოლური მოცულობა უცნობია, მისი მარტივად გამოთვლა შესაძლებელია შემდეგი სტანდარტული განტოლების გამოყენებით. გაზის მუდმივთან დაკავშირებული საკმაოდ დამაბნეველი ერთეული არის ლიტრი ატმოსფერო თითო მოლზე თითო კილოვოლტზე. არ ინერვიულოთ, თუ ეს არ ნიშნავს ამას თქვენთვის. ამასთან, გაითვალისწინეთ, რომ არსებობს რამდენიმე სხვადასხვა ვარიანტებიგაზის მუდმივი. სათანადო გამოყენება დამოკიდებული იქნება წნევის, ტემპერატურისა და მოცულობის ერთეულებზე. ეს ხშირად დაბნეულობის წყაროა სტუდენტებისთვის - და რამდენიმე მასწავლებლისთვის!
სწორედ მაშინ მიიღო გადაწყვეტილება სამუშაო რვეულის გარდა კიდევ ერთი სავალდებულო ქიმიის რვეულის - ქიმიური ლექსიკონის შენარჩუნება. სამუშაო წიგნებისგან განსხვავებით, რომლებიც შეიძლება იყოს ორიც კი ერთი სასწავლო წლის განმავლობაში, ლექსიკონი არის ერთი რვეული მთელი ქიმიის კურსისთვის. უმჯობესია, თუ ამ რვეულს აქვს 48 ფურცელი და ძლიერი ყდა.
მეცნიერების დარგი, რომელიც სწავლობს ყველა მასალის მახასიათებლებსა და შემადგენლობას, ცვლილებებს, რომლებიც მათ შეიძლება განიცადონ და ამ ცვლილებების მარეგულირებელ კანონებს. ფიზიკური ცვლილება: როდესაც სხეული იცვლის თავის გარე ფორმას, მაგრამ მისი შინაგანი შემადგენლობა იგივეა.
გაყინული წყალი დასასხმელი მინა გამოსახდილი ზეთი წყლისა და ქვიშის მაქს. . ქიმიური ცვლილება: ეს ხდება მაშინ, როდესაც ნივთიერების შიდა სტრუქტურა იცვლება, ამიტომ იქმნება სხვა განსხვავებული ნივთიერება, როგორც წესი, წვის გამო. პერანგის შეღებვა. . მეცნიერება: სამეცნიერო მეთოდით შეგროვებული ორგანიზებული ცოდნა.
ამ რვეულში მასალას ვაწყობთ შემდეგნაირად: დასაწყისში - ყველაზე მნიშვნელოვანი განმარტებები, რომლებსაც ბიჭები წერენ სახელმძღვანელოდან ან წერენ მასწავლებლის კარნახით. მაგალითად, მე-8 კლასში პირველ გაკვეთილზე ეს არის საგნის „ქიმიის“ განმარტება, „ქიმიური რეაქციების“ ცნება. მე-8 კლასში სასწავლო წლის განმავლობაში ისინი აგროვებენ ოცდაათზე მეტს. ამ განმარტებების მიხედვით, ზოგიერთ გაკვეთილზე ვატარებ გამოკითხვებს. მაგალითად, ზეპირი კითხვა ჯაჭვში, როდესაც ერთი მოსწავლე კითხვას უსვამს მეორეს, თუ მან სწორად უპასუხა, მაშინ უკვე სვამს შემდეგ კითხვას; ან, როცა ერთ მოსწავლეს სხვა სტუდენტები სვამენ კითხვებს, თუ ის ვერ უმკლავდება პასუხს, მაშინ ისინი თავად პასუხობენ. ორგანულ ქიმიაში ეს არის ძირითადად ორგანული ნივთიერებების კლასების განმარტებები და ძირითადი ცნებები, მაგალითად, "ჰომოლოგები", "იზომერები" და ა.შ.
ნაერთი: სუფთა ნივთიერებები, რომლებიც წარმოიქმნება ერთი ან მეტი ელემენტის მიერ შერწყმული ფიქსირებული პროპორციებით. დიფუზია: აირების თვისება ადვილად შეერიოს ერთმანეთს. ელემენტი: ფუნდამენტური ნივთიერებები, რომლებითაც იქმნება ყველა მატერიალური საგანი.
ენერგია: სამუშაოს შესრულების ან სითბოს გადაცემის უნარი. პოტენციური ენერგია: დაგროვილი ენერგია, რომელიც ორგანიზმს აქვს ქიმიური შემადგენლობაან თქვენი პოზიცია. აგრეგაციის მდგომარეობა: როგორ ვპოულობთ სხეულს. მტკიცედ: ის განსაზღვრავს ფორმას და მოცულობას. მათი მოლეკულები ერთმანეთთან ახლოსაა.
ჩვენი საცნობარო წიგნის ბოლოს მასალა წარმოდგენილია ცხრილებისა და დიაგრამების სახით. ბოლო გვერდზე არის პირველივე ცხრილი „ქიმიური ელემენტები. ქიმიური ნიშნები“. შემდეგ ცხრილები "ვალენტობა", "მჟავები", "ინდიკატორები", "ლითონების ძაბვის ელექტროქიმიური სერია", "ელექტრონუარყოფითობის სერია".
განსაკუთრებით მინდა ვისაუბრო ცხრილის შინაარსზე "მჟავების შესაბამისობა მჟავას ოქსიდებთან":
იგი იღებს კონტეინერის ფორმას. აირისებრი: მათ არ აქვთ გარკვეული ფორმა ან მოცულობა. უძველესი პერიოდი: პირველმა დიდმა ცივილიზაციებმა ისწავლეს ნივთიერებების შერწყმა სხვების შესაქმნელად, როგორიცაა მინა და საღებავები. მათ ყველასთვის საფუძვლად 4 ელემენტი მიიჩნიეს.
ალქიმია: მეცნიერებმა თავი მიუძღვნეს ნივთიერებების გაერთიანებას ოქროს ან სიცოცხლის ელექსირის შესაქმნელად. იატროქიმია: ალქიმიკოსებმა აღმოაჩინეს რთული ნივთიერებები სამკურნალო თვისებები. ფლოგისტონი: თეორია იმის შესახებ, რომ ნივთიერებები შეიცავდნენ ფლოგისტონს და როდესაც ისინი იწვებოდნენ, ისინი კარგავდნენ მას.
თანამედროვე ქიმია: იწყება ანტუან ლავუაზიეში, სადაც იქმნება მატერიის კონსერვაციის კანონი. მატერიის კონსერვაციის კანონი: „მატერია არ იქმნება ან ნადგურდება, არამედ მხოლოდ გარდაიქმნება“. ენერგიის შენარჩუნების კანონი: „ენერგია არ იქმნება ან ნადგურდება, არამედ გარდაიქმნება“.
| მჟავების შესაბამისობა მჟავა ოქსიდებთან | ||||
| მჟავა ოქსიდი | მჟავა | |||
| სახელი | ფორმულა | სახელი | ფორმულა | მჟავა ნარჩენი, ვალენტობა |
| ნახშირბადის მონოქსიდი (II) | CO2 | ქვანახშირი | H2CO3 | CO 3 (II) |
| გოგირდის (IV) ოქსიდი | SO2 | გოგირდოვანი | H2SO3 | SO3 (II) |
| გოგირდის (VI) ოქსიდი | SO 3 | გოგირდის | H2SO4 | SO4 (II) |
| სილიციუმის (IV) ოქსიდი | SiO2 | სილიკონი | H2SiO3 | SiO 3 (II) |
| აზოტის ოქსიდი (V) | N 2 O 5 | აზოტოვანი | HNO3 | NO 3 (I) |
| ფოსფორის (V) ოქსიდი | P2O5 | ფოსფორის | H3PO4 | PO 4 (III) |
ამ ცხრილის გააზრებისა და დამახსოვრების გარეშე მე-8 კლასის მოსწავლეებს უჭირთ ტუტეებთან მჟავა ოქსიდების რეაქციების განტოლებების შედგენა.
ელექტროლიტური დისოციაციის თეორიის შესწავლისას რვეულის ბოლოს ვწერთ სქემებსა და წესებს.
იონური განტოლებების შედგენის წესები:
1. იონების სახით ჩაწერეთ წყალში ხსნადი ძლიერი ელექტროლიტების ფორმულები.
მასა: სხეულში არსებული ნივთიერების რაოდენობა. თემა: ეს არის ის, რაც კეთდება სამყაროში. მეცნიერული მეთოდი: ქცევის ბრძანება სამეცნიერო გამოკვლევა. პრობლემის განსაზღვრა და ფორმულირება. შეაგროვეთ მონაცემები პრობლემის შესახებ. გაანალიზეთ მონაცემები და შესთავაზეთ შესაძლო გადაწყვეტილებებს.
შეადგინეთ გეგმა ან ჩაატარეთ ექსპერიმენტები. შეაფასეთ შედეგები. ნარევი: ორი ან მეტი ნივთიერების შემადგენლობა ცვლადი შემადგენლობით. ჰეტეროგენული ნარევი: არ შეიცავს ერთგვაროვან თვისებებს, მისი კომპონენტები შეიძლება გამოირჩეოდეს შეუიარაღებელი თვალით. ერთგვაროვანი ნარევი: ერთგვაროვანი შემადგენლობა ნივთიერებების კომბინაციით.
2. მოლეკულური ფორმით ჩამოწერეთ მარტივი ნივთიერებების, ოქსიდების, სუსტი ელექტროლიტების და ყველა უხსნადი ნივთიერების ფორმულები.
3. განტოლების მარცხენა მხარეს ცუდად ხსნადი ნივთიერებების ფორმულები იწერება იონური ფორმით, მარჯვნივ - მოლეკულური სახით.
ორგანული ქიმიის შესწავლისას ლექსიკონში ვწერთ ნახშირწყალბადების შემაჯამებელ ცხრილებს, ჟანგბადის და აზოტის შემცველი ნივთიერებების კლასებს, გენეტიკური ურთიერთობების სქემებს.
შერევა: ერთგვაროვანი შერეული სითხეების თვისებები. წონა: ეს არის ერთი სხეულის გრავიტაციული მიზიდულობა მეორეზე. ორგანული: ნახშირბადოვანი ნივთიერებების შესწავლა. არაორგანული ნივთიერებები: შეისწავლეთ ნივთიერებები, რომლებიც არ შეიცავს ნახშირბადს. ანალიტიკური: ნივთიერების შემადგენლობის შესწავლა.
ბიოქიმია: კვლევა ქიმიური რეაქციებიცოცხალი ორგანიზმები. გამოსავალი: ეს არის ერთგვაროვანი ნარევი, აქვს ერთგვაროვანი შემადგენლობა და გარეგნობა. სუფთა ნივთიერება: ინდივიდუალური ქიმიური ნივთიერება, რომელიც მთლიანად შედგება ერთი კლასის მატერიისგან. სიბლანტე: სითხის წინააღმდეგობის გაჟონვა ადვილია.
| ფიზიკური რაოდენობები | |||
| Დანიშნულება | სახელი | ერთეულები | ფორმულები |
| ნივთიერების რაოდენობა | მოლი | = N / N A; = მ / მ; V/V მ (გაზებისთვის) |
|
| ნ ა | ავოგადროს მუდმივი | მოლეკულები, ატომები და სხვა ნაწილაკები | N A = 6.02 10 23 |
| ნ | ნაწილაკების რაოდენობა | მოლეკულები, ატომები და სხვა ნაწილაკები |
N = N A |
| მ | მოლური მასა | გ/მოლი, კგ/კმოლ | M = m / ; / მ/ = მ რ |
| მ | წონა | გ, კგ | m = M; m = V |
| ვმ | გაზის მოლური მოცულობა | ლ / მოლი, მ 3 / კმოლ | Vm \u003d 22,4 ლ / მოლი \u003d 22,4 მ 3 / კმოლ |
| ვ | მოცულობა | ლ, მ 3 | V = V m (აირებისთვის); |
| სიმჭიდროვე | გ/მლ; | = მ/ვ; M/V m (გაზებისთვის) პროტონი: სუბატომური ნაწილაკი, რომელსაც აქვს დადებითი მუხტი და არის ატომის ბირთვის ნაწილი. ნეიტრონი: ელექტრული ნეიტრალური ნაწილაკი, რომელიც ნაპოვნია პროტონის გვერდით მდებარე ბირთვში. ელექტრონი: უარყოფითად დამუხტული ნაწილაკი, რომელიც იკავებს ატომის მიმდებარე სივრცეს. მასა ან ატომური წონა: ატომის ატომების საშუალო შეწონილი მასა. ეს არის პროტონებისა და ელექტრონების ჯამი. იგი წარმოდგენილია ასო A. ატომური რიცხვი: ატომის პროტონების რაოდენობა. იზოტოპი: კონკრეტული ელემენტის ატომები, რომლებსაც აქვთ ნეიტრონების განსხვავებული რაოდენობა. ანიონები: იონი უარყოფითი მუხტით. |
|
25-ისთვის - ზაფხულის პერიოდისკოლაში ქიმიას ვასწავლიდი, სხვადასხვა პროგრამით და სახელმძღვანელოებით მიწევდა მუშაობა. ამავდროულად, ყოველთვის გასაკვირი იყო, რომ პრაქტიკულად არც ერთი სახელმძღვანელო არ ასწავლის პრობლემების გადაჭრას. ქიმიის შესწავლის დასაწყისში, ლექსიკონში ცოდნის სისტემატიზაციისა და კონსოლიდაციის მიზნით, მე და მოსწავლეები ვადგენთ ცხრილს „ფიზიკური სიდიდეები“ ახალი რაოდენობით:
კათიონები: დადებითად დამუხტული იონები. ყველა ელემენტი შედგება პაწაწინა, განუყოფელი ნაწილაკებისგან, სახელწოდებით „ატომები“, რომელთა განადგურება შეუძლებელია. ელემენტის ყველა ატომი ერთნაირია. ფიქსირებული პროპორციებით შერეული ელემენტების ყველა ატომი ქმნის ნაერთებს.
ქიმიური რეაქცია მოიცავს ცვლილებას. მუდმივი შემადგენლობის კანონი. ნაერთი ყოველთვის შეიცავს ელემენტებს გარკვეული განსაზღვრული პროპორციებით და სხვა კომბინაციით. მას ასევე უწოდებენ გარკვეული პროპორციების კანონს. ეს გამოაცხადა ჯოზეფ პრუსტმა.
თუ ორი ელემენტი ქმნის ერთზე მეტ ნაერთს, ელემენტების სხვადასხვა მასას, რომლებიც გაერთიანდება მეორე ელემენტის ფიქსირებულ მასაში, აქვს მთელი რიცხვების ერთი ფრაქცია. მოლეკულური წონა: ჯამი ატომური მასებითითოეული ატომი, რომელიც ქმნის მოლეკულას. ავოგადროს რიცხვი: ნაწილაკების რაოდენობა მოლზე.
როდესაც ასწავლის სტუდენტებს გამოთვლითი ამოცანების ამოხსნას, დიდი მნიშვნელობამე ვაძლევ ალგორითმებს. მიმაჩნია, რომ მოქმედებების თანმიმდევრობის მკაცრი დანიშვნა საშუალებას აძლევს სუსტ მოსწავლეს გაიგოს გარკვეული ტიპის პრობლემების გადაწყვეტა. ძლიერი სტუდენტებისთვის, ეს არის შესაძლებლობა, მიაღწიონ შემდგომი ქიმიური განათლებისა და თვითგანათლების შემოქმედებით დონეს, რადგან პირველ რიგში საჭიროა დამაჯერებლად დაეუფლონ სტანდარტული ტექნიკის შედარებით მცირე რაოდენობას. ამის საფუძველზე განვითარდება მათი სწორად გამოყენების უნარი უფრო რთული პრობლემების გადაჭრის სხვადასხვა ეტაპზე. ამიტომ, მე შევადგინე გამოთვლითი ამოცანების გადაჭრის ალგორითმები ყველა ტიპის სასკოლო კურსის ამოცანებისთვის და კლასგარეშე აქტივობებისთვის.
მაგალითად: ერთი მოლი უდრის თითოეული ატომის ატომური მასების ჯამს, რომელიც ქმნის ნაერთის მოლეკულას. ეს რიცხვი ტოლი იქნება ამ ნაერთის ერთი მოლის. პირველ რიგში, პროპორციის წესი შესრულებულია. პირველ რიგში, გამოითვლება მოლეკულური წონა. ატომების ელექტრონები ენერგეტიკულ დონეზე, ანუ შრეებშია, რომლებიც ენერგიას მატულობენ ატომის ბირთვიდან მანძილის მატებასთან ერთად. ამიტომ, რაც უფრო ახლოს არის ელექტრონი ატომის ცენტრთან, მით უფრო დაბალია მისი ენერგია. ეს კვანტური რიცხვები აღინიშნება მთელი რიცხვებით ან ასოებით.
მთავარი კვანტური რიცხვი განსაზღვრავს ორბიტის ენერგიას. ელექტრონები, რომლებიც ავსებენ ატომის ბოლო ენერგეტიკულ დონეს, ცნობილია როგორც ვალენტური ელექტრონები. ელექტრონების მაქსიმალური რაოდენობა, რომლის დაშვებაც შესაძლებელია ბოლო დონე, არის რვა ელექტრონი, გარდა წყალბადისა და ჰელიუმის ატომებისა, რომლებსაც აქვთ ვალენტური ელექტრონების მაქსიმალური რაოდენობა.
ზოგიერთი მათგანის მაგალითებს მოვიყვან.
ქიმიური განტოლებებით ამოცანების ამოხსნის ალგორითმი.
1. მოკლედ ჩამოწერეთ ამოცანის პირობა და შეადგინეთ ქიმიური განტოლება.
2. ქიმიური განტოლების ფორმულების ზემოთ ჩაწერეთ ამოცანის მონაცემები, ჩაწერეთ მოლების რაოდენობა ფორმულების ქვეშ (განისაზღვრება კოეფიციენტით).
3. იპოვეთ ნივთიერების რაოდენობა, რომლის მასა ან მოცულობა მოცემულია ამოცანის პირობებში, ფორმულების გამოყენებით:
მ/მ; \u003d V / V m (აირებისთვის V m \u003d 22,4 ლ / მოლი).
დაწერეთ მიღებული რიცხვი ფორმულის ზემოთ განტოლებაში.
4. იპოვეთ ნივთიერების რაოდენობა, რომლის მასა ან მოცულობა უცნობია. ამისათვის დაასაბუთეთ განტოლების მიხედვით: შეადარეთ მოლების რაოდენობა პირობის მიხედვით მოლების რაოდენობას განტოლების მიხედვით. საჭიროების შემთხვევაში პროპორცია.
5. იპოვეთ მასა ან მოცულობა ფორმულების გამოყენებით: m = M ; V = V მ.
ეს ალგორითმი არის საფუძველი, რომელსაც მოსწავლე უნდა დაეუფლოს, რათა მომავალში შეძლოს ამოცანების ამოხსნა სხვადასხვა გართულების მქონე განტოლებების გამოყენებით.
ამოცანები ჭარბი და დეფიციტისთვის.
თუ პრობლემის პირობებში ერთდროულად ცნობილია ორი მოძრავი ნივთიერების რაოდენობა, მასა ან მოცულობა, მაშინ ეს არის სიჭარბისა და დეფიციტის პრობლემა.
მისი გადაჭრისას:
1. ფორმულების მიხედვით აუცილებელია ორი მორეაქტიული ნივთიერების ოდენობის პოვნა:
მ/მ; = V/V მ .
2. მოლების შედეგად მიღებული რიცხვები ჩაწერილია განტოლების ზემოთ. მათი შედარება მოლების რაოდენობასთან განტოლების მიხედვით, გამოიტანე დასკვნა, თუ რომელი ნივთიერებაა მოცემული დეფიციტით.
3. დეფიციტის მიხედვით, გააკეთეთ შემდგომი გამოთვლები.
რეაქციის პროდუქტის გამოსავლიანობის წილის ამოცანები, პრაქტიკულად მიღებული თეორიულად შესაძლებელი.
რეაქციის განტოლებების მიხედვით ტარდება თეორიული გამოთვლები და მოიძებნება თეორიული მონაცემები რეაქციის პროდუქტზე: თეორი. მ თეორ. ან V თეორია. . ლაბორატორიაში ან მრეწველობაში რეაქციების განხორციელებისას ზარალი ხდება, ამიტომ მიღებული პრაქტიკული მონაცემები პრაქტიკულია. ,
მ პრაქტიკული ან V პრაქტიკული. ყოველთვის ნაკლებია თეორიულად გამოთვლილ მონაცემებზე. მოსავლიანობის წილადი აღინიშნება ასო (ეტა) და გამოითვლება ფორმულებით:
(ეს) = პრაქტიკა. / თეორია. = m პრაქტიკული. / მ თეორი. = V პრაქტიკული. / V თეორია.
იგი გამოიხატება როგორც ერთეულის წილადი ან პროცენტულად. არსებობს სამი სახის დავალება:
თუ საწყისი ნივთიერების მონაცემები და რეაქციის პროდუქტის გამოსავლიანობის წილი ცნობილია პრობლემის პირობებში, მაშინ თქვენ უნდა იპოვოთ პრაქტიკული. , მ პრაქტიკული ან V პრაქტიკული. რეაქციის პროდუქტი.
გადაწყვეტის თანმიმდევრობა:
1. გამოთვალეთ განტოლების მიხედვით, საწყისი ნივთიერების მონაცემებზე დაყრდნობით, იპოვეთ თეორია. მ თეორ. ან V თეორია. რეაქციის პროდუქტი;
2. იპოვეთ რეაქციის პროდუქტის მასა ან მოცულობა, პრაქტიკულად მიღებული ფორმულების მიხედვით:
მ პრაქტიკული = მ თეორია. ; V პრაქტიკა. = V თეორია. ; პრაქტიკული = თეორია. .
თუ პრობლემის პირობებში ცნობილია საწყისი ნივთიერებისა და პრაქტიკის მონაცემები. , მ პრაქტიკული ან V პრაქტიკული. მიღებული პროდუქტის, მაშინ როცა საჭიროა რეაქციის პროდუქტის გამოსავლიანობის წილის პოვნა.
გადაწყვეტის თანმიმდევრობა:
1. გამოთვალეთ განტოლების მიხედვით, საწყისი ნივთიერების მონაცემებზე დაყრდნობით, იპოვეთ
თეორ. მ თეორ. ან V თეორია. რეაქციის პროდუქტი.
2. იპოვეთ რეაქციის პროდუქტის გამოსავლიანობის წილი ფორმულების გამოყენებით:
პრაქტ. / თეორია. = m პრაქტიკული. / მ თეორი. = V პრაქტიკული. /V თეორია.
თუ პრობლემის მდგომარეობაში ცნობილია პრაქტიკა. , მ პრაქტიკული ან V პრაქტიკული. შედეგად მიღებული რეაქციის პროდუქტისა და მისი მოსავლიანობის წილი, ამ შემთხვევაში, თქვენ უნდა იპოვოთ მონაცემები საწყისი ნივთიერებისთვის.
გადაწყვეტის თანმიმდევრობა:
1. იპოვე თეორ., მ თეორ. ან V თეორია. რეაქციის პროდუქტი ფორმულების მიხედვით:
თეორ. = პრაქტიკული / ; მ თეორია. = m პრაქტიკული. / ; V თეორია. = V პრაქტიკული. / .
2. გამოთვალეთ განტოლების მიხედვით, თეორიაზე დაყრდნობით. მ თეორ. ან V თეორია. რეაქციის პროდუქტი და მოიძიეთ საწყისი მასალის მონაცემები.
რა თქმა უნდა, ამ სამი სახის პრობლემას განვიხილავთ ეტაპობრივად, ვმუშაობთ თითოეული მათგანის გადაჭრის უნარ-ჩვევებს რიგი პრობლემის მაგალითზე.
პრობლემები ნარევებსა და მინარევებს.
სუფთა ნივთიერება არის ის, რაც ნარევში მეტია, დანარჩენი მინარევებია. აღნიშვნები: ნარევის მასა - მ სმ, სუფთა ნივთიერების მასა - m q.v., მინარევების მასა - მ დაახლ. , სუფთა ნივთიერების მასური წილი - ჰ.ვ.
სუფთა ნივთიერების მასური წილი გვხვდება ფორმულით: ჰ.ვ. = მ ქ.ვ. / მ იხილეთ, გამოხატეთ იგი ერთეულის ფრაქციებში ან პროცენტულად. გამოვყოფთ დავალების 2 ტიპს.
თუ პრობლემის პირობებში მოცემულია სუფთა ნივთიერების მასური წილი ან მინარევების მასური წილი, მაშინ მოცემულია ნარევის მასა. სიტყვა "ტექნიკური" ასევე ნიშნავს ნარევის არსებობას.
გადაწყვეტის თანმიმდევრობა:
1. იპოვეთ სუფთა ნივთიერების მასა ფორმულის გამოყენებით: m p.m. = ქ.ვ. ვხედავ.
თუ მოცემულია მინარევების მასობრივი წილი, მაშინ ჯერ უნდა იპოვოთ სუფთა ნივთიერების მასური წილი: = 1 - დაახლ.
2. სუფთა ნივთიერების მასიდან გამომდინარე გააკეთეთ შემდგომი გამოთვლები განტოლების მიხედვით.
თუ პრობლემის მდგომარეობა იძლევა საწყისი ნარევის მასას და რეაქციის პროდუქტის n, m ან V-ს, მაშინ თქვენ უნდა იპოვოთ სუფთა ნივთიერების მასური წილი საწყის ნარევში ან მასში არსებული მინარევების მასობრივი წილი.
გადაწყვეტის თანმიმდევრობა:
1. გამოთვალეთ განტოლების მიხედვით, რეაქციის პროდუქტის მონაცემებზე დაყრდნობით და იპოვეთ n საათი. და მ ჰ.ვ.
2. იპოვეთ სუფთა ნივთიერების მასური წილი ნარევში ფორმულით: q.v. = მ ქ.ვ. / მ მინარევების დანახვა და მასობრივი ფრაქცია: დაახლ. = 1 - სთ.
აირების მოცულობითი შეფარდების კანონი.
გაზების მოცულობა დაკავშირებულია ისევე, როგორც მათი ნივთიერებების რაოდენობა:
V 1 / V 2 = 1 / 2
ეს კანონი გამოიყენება ამოცანების ამოხსნისას განტოლებებით, რომლებშიც მოცემულია გაზის მოცულობა და საჭიროა სხვა გაზის მოცულობის პოვნა.
გაზის მოცულობითი წილი ნარევში.
Vg / Vcm, სადაც (phi) არის გაზის მოცულობითი ფრაქცია.
Vg არის გაზის მოცულობა, Vcm არის აირების ნარევის მოცულობა.
თუ ამოცანის პირობებში მოცემულია გაზის მოცულობითი ფრაქცია და ნარევის მოცულობა, მაშინ, პირველ რიგში, თქვენ უნდა იპოვოთ გაზის მოცულობა: Vg = Vcm.
აირების ნარევის მოცულობა გვხვდება ფორმულით: Vcm \u003d Vg /.
ნივთიერების დაწვაზე დახარჯული ჰაერის მოცულობა გამოვლენილია ჟანგბადის მოცულობის მეშვეობით, რომელიც ნაპოვნია განტოლებით:
ვაირ \u003d V (O 2) / 0.21
ორგანული ნივთიერებების ფორმულების წარმოშობა ზოგადი ფორმულებით.
ორგანული ნივთიერებები ქმნიან ჰომოლოგიურ სერიებს, რომლებსაც აქვთ საერთო ფორმულები. ეს საშუალებას იძლევა:
1. გამოთქვით ფარდობითი მოლეკულური წონა რიცხვით n.
M r (C n H 2n + 2) = 12n + 1 (2n + 2) = 14n + 2.
2. გააუტოლეთ n-ით გამოხატული M r ჭეშმარიტ M r-ს და იპოვეთ n.
3. შეადგინეთ რეაქციის განტოლებები ში ზოგადი ხედიდა შეასრულეთ გამოთვლები მათზე.
ნივთიერებების ფორმულების მიღება წვის პროდუქტებით.
1. გააანალიზეთ წვის პროდუქტების შემადგენლობა და გამოიტანეთ დასკვნა დამწვარი ნივთიერების ხარისხობრივი შემადგენლობის შესახებ: H 2 O -> H, CO 2 -> C, SO 2 -> S, P 2 O 5 -> P, Na. 2 CO 3 -> Na, C.
ნივთიერებაში ჟანგბადის არსებობა საჭიროებს შემოწმებას. მიუთითეთ ფორმულის ინდექსები x, y, z. მაგალითად, CxHyOz (?).
2. იპოვეთ წვის პროდუქტების ნივთიერებების რაოდენობა ფორმულების გამოყენებით:
n = m / M და n = V / Vm.
3. იპოვეთ დამწვარი ნივთიერებაში შემავალი ელემენტების რაოდენობა. Მაგალითად:
რიცხვების გადაყვანა მთელ რიცხვებად მათი უმცირესზე გაყოფით.
დაწერეთ ნამდვილი ფორმულა.
ნივთიერებების ფორმულების წარმოშობა ელემენტების მასის წილადებით.
1. დაწერეთ ფორმულა, რომ აღვნიშნოთ x, y, z-ის მეშვეობით მაჩვენებლები.
2. იპოვეთ ინდექსის თანაფარდობა, ამისათვის გაყავით თითოეული ელემენტის მასური წილი მის ატომურ მასაზე: x: y: z = 1 / Ar 1: 2 / Ar 2: 3 / Ar 3.
3. მიღებული რიცხვების დაყვანა მთელ რიცხვებად მათგან უმცირესზე გაყოფით. საჭიროების შემთხვევაში, გაყოფის შემდეგ გაამრავლეთ 2-ზე, 3, 4, 5-ზე.
ამოხსნის ეს გზა განსაზღვრავს უმარტივეს ფორმულას. არაორგანული ნივთიერებების უმეტესობისთვის ის ემთხვევა ნამდვილს, ორგანულ ნივთიერებებს კი პირიქით.
ნივთიერების ფორმულების წარმოშობა ელემენტების მასის წილადებით, თუ ცნობილია ნივთიერების მოლური მასის პოვნის მონაცემები.
იპოვეთ ნივთიერების მოლური მასა ფორმულების გამოყენებით:
ა) თუ გაზის სიმკვრივე ცნობილია: M = Vm = გ/ლ 22,4 ლ/მოლი; r = m / V.
ბ) თუ ცნობილია ფარდობითი სიმკვრივე: M 1 = D 2 M 2, M = D H2 2, M = D O2 32,
M = D ჰაერი. 29, M = D N2 28 და ა.შ.
1 გზა: იპოვეთ ნივთიერების უმარტივესი ფორმულა (იხ. წინა ალგორითმი) და უმარტივესი მოლური მასა. შემდეგ შეადარეთ ნამდვილი მოლური მასა უმარტივესთან და გაზარდეთ ფორმულის მაჩვენებლები საჭირო რაოდენობის ჯერ.
2 გზა: იპოვეთ ინდექსები ფორმულის გამოყენებით n = (e) Mr / Ar (e).
თუ რომელიმე ელემენტის მასობრივი წილი უცნობია, მაშინ ის უნდა მოიძებნოს. ამისთვის სხვა ელემენტის მასური წილი გამოვაკლოთ 100%-ს ან ერთიანობას.
თანდათანობით, ქიმიის შესწავლის პროცესში ქიმიის ლექსიკონში გროვდება პრობლემების გადაჭრის ალგორითმები. განსხვავებული ტიპები. მოსწავლემ კი ყოველთვის იცის, სად უნდა მოძებნოს სწორი ფორმულა ან სწორი ინფორმაცია პრობლემის გადასაჭრელად.
ბევრ სტუდენტს მოსწონს ასეთი რვეულის შენახვა, ისინი თავად ავსებენ მას სხვადასხვა საცნობარო მასალებით.
რაც შეეხება კლასგარეშე აქტივობებს, მე და მოსწავლეები ასევე ვიწყებთ ცალკე რვეულს ალგორითმების დასაწერად სცილდება პრობლემების გადასაჭრელად. სკოლის სასწავლო გეგმა. იმავე რვეულში თითოეული ტიპის დავალებაზე ვწერთ 1-2 მაგალითს, დანარჩენ დავალებებს სხვა რვეულში წყვეტენ. და თუ დაფიქრდებით, ათასობით სხვადასხვა დავალებას შორის, რომლებიც ქიმიის გამოცდაზე გვხვდება ყველა უნივერსიტეტში, შეიძლება განასხვავოთ 25 - 30 სხვადასხვა ტიპის დავალება. რა თქმა უნდა, მათ შორის ბევრი ვარიაციაა.
არჩევით კლასებში ამოცანების გადაჭრის ალგორითმების შემუშავებისას ა.ა. კუშნარევი. (ქიმიის ამოცანების ამოხსნის სწავლა, - მ., სკოლა - პრესა, 1996 წ.).
ქიმიაში ამოცანების გადაჭრის უნარი საგნის შემოქმედებითი ასიმილაციის მთავარი კრიტერიუმია. ქიმიის კურსის ეფექტურად ათვისება შესაძლებელია სხვადასხვა დონის სირთულის პრობლემების გადაჭრის გზით.
თუ სტუდენტს აქვს მკაფიო წარმოდგენა ყველა შესაძლო ტიპის ამოცანის შესახებ, გადაჭრა თითოეული ტიპის დავალების დიდი რაოდენობა, მაშინ მას შეუძლია გაუმკლავდეს გამოცდის ჩაბარებას ქიმიაში ერთიანი სახელმწიფო გამოცდის სახით და უნივერსიტეტებში შესვლას. .
შეიძლება სასარგებლო იყოს წაკითხვა:
- რა ძლიერი მხარეები უნდა იყოს მითითებული რეზიუმეში?;
- პიროვნების მოტივაციის დიაგნოსტიკის მეთოდები;
- რა უნდა იცოდნენ ქვეშევრდომებმა?;
- თქვენი გრძნობების ვერბალიზაცია;
- დროის განაწილების მატრიცა (სტივენ კოვეის მიხედვით);
- გუნდში კონფლიქტების მოგვარება მაგალითები, თუ როგორ უნდა მოგვარდეს კონფლიქტები სამუშაო გუნდში;
- ტყის საკვები სოკოების სია ფოტოებით, სახელებითა და აღწერილობებით;
- მაჰოგანი, როგორც მასალა;