So berechnen Sie die niedrigste Oxidationsstufe. Wie hoch ist der Oxidationsgrad? Wie bestimmt man den Oxidationszustand von Elementen?
So ein Artikel Lehrplan Da die Chemie den meisten modernen Schulkindern zahlreiche Schwierigkeiten bereitet, können nur wenige den Oxidationsgrad von Verbindungen bestimmen. Die größten Schwierigkeiten haben Schüler, die anorganische Chemie studieren, also Schüler der Grundschule (Klassen 8-9). Missverständnisse in Bezug auf das Fach führen dazu, dass unter den Schülern Feindseligkeit gegenüber diesem Fach entsteht.
Lehrer nennen eine Reihe von Gründen für eine solche „Abneigung“ von Schülern der Mittel- und Oberstufe gegenüber Chemie: mangelnde Bereitschaft, komplexe chemische Begriffe zu verstehen, Unfähigkeit, Algorithmen zur Betrachtung eines bestimmten Prozesses zu verwenden, Probleme mit mathematischen Kenntnissen. Das Bildungsministerium der Russischen Föderation hat den Inhalt des Fachs grundlegend geändert. Außerdem wurde die Stundenzahl für den Chemieunterricht „abgesenkt“. Dies hatte negative Auswirkungen auf die Qualität des Wissens im Fach, ein abnehmendes Interesse am Studium der Disziplin.
Welche Themen des Chemiekurses sind für Schüler am schwierigsten?
Von neues Programm Der Kurs der akademischen Disziplin "Chemie" der Grundschule umfasst mehrere ernste Themen: das Periodensystem der Elemente von D. I. Mendeleev, Klassen anorganischer Substanzen, Ionenaustausch. Das Schwierigste für Achtklässler ist die Definition von Oxiden.
Platzierungsregeln
Zunächst einmal sollten die Schüler wissen, dass Oxide komplexe Verbindungen aus zwei Elementen sind, die Sauerstoff enthalten. Voraussetzung Die Zugehörigkeit einer binären Verbindung zur Klasse der Oxide ist die zweite Sauerstoffstelle in dieser Verbindung.
Algorithmus für Säureoxide
Zunächst stellen wir fest, dass die Oxidationsstufen numerische Ausdrücke für die Wertigkeit der Elemente sind. gebildet durch Nichtmetalle oder Metalle mit einer Wertigkeit von vier bis sieben, ist das zweite in solchen Oxiden notwendigerweise Sauerstoff.
In Oxiden entspricht die Wertigkeit von Sauerstoff immer zwei und kann aus dem Periodensystem der Elemente von D. I. Mendeleev bestimmt werden. Ein so typisches Nichtmetall wie Sauerstoff, das in der 6. Gruppe der Hauptnebengruppe des Periodensystems steht, nimmt zwei Elektronen auf, um sein äußeres Energieniveau vollständig zu vervollständigen. Nichtmetalle in Verbindungen mit Sauerstoff weisen meist eine höhere Wertigkeit auf, die der Nummer der Gruppe selbst entspricht. Es ist wichtig, sich daran zu erinnern, dass der Oxidationszustand chemischer Elemente ein Indikator ist, der eine positive (negative) Zahl impliziert.
Das Nichtmetall am Anfang der Formel hat eine positive Oxidationsstufe. Nichtmetallischer Sauerstoff ist in Oxiden stabil, sein Index ist -2. Um die Zuverlässigkeit der Anordnung von Werten in Säureoxiden zu überprüfen, müssen Sie alle von Ihnen festgelegten Zahlen mit den Indizes eines bestimmten Elements multiplizieren. Berechnungen gelten als zuverlässig, wenn die Gesamtsumme aller Plus- und Minuspunkte der eingestellten Grade 0 beträgt.

Zusammenstellung von Zwei-Element-Formeln
Der Oxidationszustand der Atome der Elemente bietet die Möglichkeit, Verbindungen aus zwei Elementen herzustellen und aufzuzeichnen. Wenn Sie eine Formel erstellen, werden zunächst beide Symbole nebeneinander geschrieben, achten Sie darauf, Sauerstoff an zweiter Stelle zu setzen. Über jedem der aufgezeichneten Zeichen sind die Werte der Oxidationsstufen vorgeschrieben, dann steht zwischen den gefundenen Zahlen die Zahl, die ohne Rest durch beide Ziffern teilbar ist. Dieser Indikator muss separat durch den Zahlenwert des Oxidationsgrades geteilt werden, wodurch Indizes für die erste und zweite Komponente der Zwei-Element-Substanz erhalten werden. Die höchste Oxidationsstufe ist zahlenmäßig gleich dem Wert der höchsten Wertigkeit eines typischen Nichtmetalls, identisch mit der Gruppennummer, in der das Nichtmetall in PS steht.
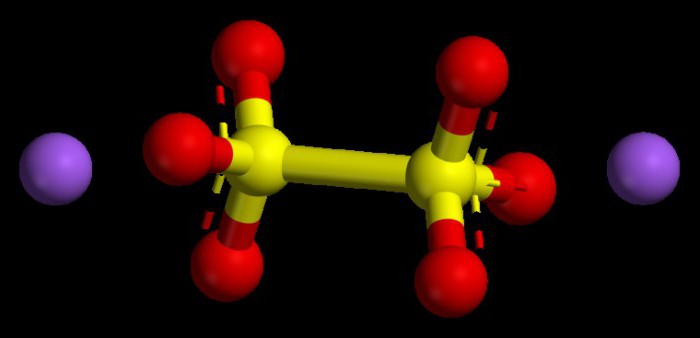
Algorithmus zum Setzen von Zahlenwerten in basischen Oxiden
Als solche Verbindungen werden Oxide typischer Metalle angesehen. Sie haben in allen Verbindungen einen Oxidationszustandsindex von nicht mehr als +1 oder +2. Um den Oxidationszustand eines Metalls zu verstehen, können Sie das Periodensystem verwenden. Für Metalle der Hauptuntergruppen der ersten Gruppe ist dieser Parameter immer konstant, er ähnelt der Gruppennummer, dh +1.
Metalle der Hauptuntergruppe der zweiten Gruppe zeichnen sich auch durch eine stabile Oxidationsstufe aus, numerisch +2. Die Oxidationsstufen von Oxiden sollten sich unter Berücksichtigung ihrer Indizes (Zahlen) zu Null addieren, da das chemische Molekül als neutrales, ladungsfreies Teilchen betrachtet wird.
Anordnung der Oxidationsstufen in sauerstoffhaltigen Säuren
Säuren sind komplexe Substanzen, die aus einem oder mehreren Wasserstoffatomen bestehen, die mit einer Art Säurerest verbunden sind. Da Oxidationsstufen Zahlen sind, sind einige mathematische Fähigkeiten erforderlich, um sie zu berechnen. Ein solcher Indikator für Wasserstoff (Proton) in Säuren ist immer stabil, er ist +1. Als nächstes können Sie die Oxidationsstufe für das negative Sauerstoffion angeben, es ist auch stabil, -2.
Erst nach diesen Aktionen ist es möglich, den Oxidationsgrad der zentralen Komponente der Formel zu berechnen. Betrachten Sie als spezifische Probe die Bestimmung des Oxidationszustands von Elementen in Schwefelsäure H2SO4. Da das Molekül dieser komplexen Substanz zwei Wasserstoffprotonen und 4 Sauerstoffatome enthält, erhalten wir einen Ausdruck dieser Form +2+X-8=0. Damit die Summe Null bildet, hat Schwefel eine Oxidationsstufe von +6
Anordnung der Oxidationsstufen in Salzen
Salze sind komplexe Verbindungen, die aus Metallionen und einem oder mehreren Säureresten bestehen. Verfahren zur Bestimmung der Oxidationsstufen von jedem Bestandteile in einem Komplexsalz ist dasselbe wie in sauerstoffhaltigen Säuren. Da der Oxidationszustand der Elemente ein numerischer Indikator ist, ist es wichtig, den Oxidationszustand des Metalls korrekt anzugeben.
Befindet sich das salzbildende Metall in der Hauptnebengruppe, ist seine Oxidationsstufe stabil, entspricht der Gruppenzahl, ist ein positiver Wert. Wenn das Salz ein Metall einer ähnlichen Untergruppe von PS enthält, ist es möglich, verschiedene Metalle durch den Säurerest anzuzeigen. Nachdem der Oxidationszustand des Metalls eingestellt ist, geben Sie (-2) ein, dann wird der Oxidationszustand des zentralen Elements mithilfe der chemischen Gleichung berechnet.
Betrachten Sie als Beispiel die Bestimmung der Oxidationsstufen von Elementen in (Medium Salz). NaNO3. Das Salz wird von einem Metall der Hauptuntergruppe der Gruppe 1 gebildet, daher ist die Oxidationsstufe von Natrium +1. Sauerstoff in Nitraten hat eine Oxidationsstufe von -2. Zur Bestimmung des Zahlenwertes des Oxidationsgrades gilt die Gleichung +1+X-6=0. Wenn wir diese Gleichung lösen, erhalten wir, dass X +5 sein sollte, das ist

Grundbegriffe in OVR
Sowohl für den oxidativen als auch für den reduzierenden Prozess gibt es spezielle Begriffe, die von den Studierenden erlernt werden müssen.
Der Oxidationszustand eines Atoms ist seine direkte Fähigkeit, Elektronen von einigen Ionen oder Atomen an sich selbst zu binden (an andere zu spenden).
Neutrale Atome oder geladene Ionen gelten als Oxidationsmittel. chemische Reaktion Elektronen aufnehmen.
Das Reduktionsmittel sind ungeladene Atome oder geladene Ionen, die im Prozess der chemischen Wechselwirkung ihre eigenen Elektronen verlieren.
Die Oxidation wird als Verfahren zur Abgabe von Elektronen vorgestellt.
Reduktion ist mit der Aufnahme zusätzlicher Elektronen durch ein ungeladenes Atom oder Ion verbunden.
Der Redoxprozess ist durch eine Reaktion gekennzeichnet, bei der sich zwangsläufig die Oxidationsstufe eines Atoms ändert. Diese Definition ermöglicht Ihnen zu verstehen, wie Sie feststellen können, ob es sich bei der Reaktion um OVR handelt.

OVR-Parsing-Regeln
Mit diesem Algorithmus können Sie die Koeffizienten in jeder chemischen Reaktion anordnen.
Der letzte Schritt wird die Anordnung der stereochemischen Koeffizienten in der betrachteten Reaktion sein.
OVR-Beispiel
Zuerst müssen Sie die Oxidationsstufen in jeder chemischen Substanz ordnen. Beachten Sie, dass der Oxidationszustand Null ist, da es keine Rückkehr (Anhaftung) von negativen Partikeln gibt. Die Regeln für die Anordnung der Oxidationsstufen in binären und dreielementigen Substanzen wurden von uns oben diskutiert.
Dann müssen Sie diejenigen Atome oder Ionen bestimmen, bei denen sich während der Umwandlung die Oxidationsstufen geändert haben.
Von der linken Seite der geschriebenen Gleichung werden Atome oder geladene Ionen isoliert, die ihre Oxidationsstufe geändert haben. Dies ist für die Bilanz notwendig. Über den Elementen müssen ihre Werte angegeben werden.
Weiterhin werden jene Atome oder Ionen aufgezeichnet, die während der Reaktion entstanden sind, gekennzeichnet durch das Zeichen +, die Anzahl der vom Atom aufgenommenen Elektronen, - die Anzahl der abgegebenen negativen Teilchen. Wenn nach dem Wechselwirkungsprozess die Oxidationsstufen abnehmen. Das bedeutet, dass die Elektronen vom Atom (Ion) aufgenommen wurden. Mit zunehmendem Oxidationsgrad gibt ein Atom (Ion) während der Reaktion Elektronen ab.
Am wenigsten Gesamtzahl Erst durch die aufgenommenen, dann durch die dabei abgegebenen Elektronen dividiert, erhält man die Koeffizienten. Die gefundenen Zahlen sind die gewünschten stereochemischen Koeffizienten.
Bestimmen Sie das Oxidationsmittel, das Reduktionsmittel und die während der Reaktion ablaufenden Prozesse.
Betrachten Sie die praktische Anwendung dieses Algorithmus für eine bestimmte chemische Reaktion.
Fe+CuSO4=Cu+FeSO4
Wir berechnen die Indikatoren für alle einfachen und komplexen Stoffe.
Da Fe und Cu einfache Substanzen sind, ist ihre Oxidationsstufe 0. In CuSO4 hat dann Cu + 2, dann Sauerstoff -2 und Schwefel +6. In FeSO4: Fe +2, also für O-2 nach den Berechnungen S +6.
Jetzt suchen wir nach Elementen, die die Indikatoren verändern könnten, in unserer Situation werden es Fe und Cu sein.
Da nach der Reaktion der Wert des Eisenatoms +2 wurde, wurden bei der Reaktion 2 Elektronen abgegeben. Kupfer hat seine Indikatoren von +2 auf 0 geändert, daher hat Kupfer 2 Elektronen aufgenommen. Nun bestimmen wir die Anzahl der aufgenommenen und abgegebenen Elektronen durch das Eisenatom und das zweiwertige Kupferkation. Bei der Umwandlung wurden zwei Elektronen vom zweiwertigen Kupferkation aufgenommen und die gleiche Anzahl Elektronen vom Eisenatom abgegeben.
Dabei macht es keinen Sinn, das kleinste gemeinsame Vielfache zu bestimmen, da bei der Umwandlung gleich viele Elektronen aufgenommen und abgegeben werden. Die stereochemischen Koeffizienten entsprechen ebenfalls Eins. In der Reaktion zeigt Eisen die Eigenschaften des Reduktionsmittels, während es oxidiert wird. Das zweiwertige Kupferkation wird bei der Reaktion zu reinem Kupfer reduziert Höchster Abschluss Oxidation.

Anwendung von Prozessen
Die Oxidationszustandsformeln sollten jedem Schüler der Klassen 8-9 bekannt sein, da dieses Thema in enthalten ist OGE-Aufträge. Alle Prozesse, die mit oxidativen, reduzierenden Zeichen ablaufen, spielen eine Rolle Bedeutung in unserem Leben. Ohne sie sind Stoffwechselvorgänge im menschlichen Körper nicht möglich.
Teil I
1. Die Oxidationsstufe (s. o.) ist bedingte Ladung der Atome eines chemischen Elements in einem komplexen Stoff, berechnet auf der Grundlage der Annahme, dass dieser aus einfachen Ionen besteht.
Sollte wissen!
1) In Verbindung mit. Ö. Wasserstoff = +1, außer für Hydride.
2) In Verbindungen mit. Ö. Sauerstoff = -2, mit Ausnahme von Peroxiden ![]() und Fluoride
und Fluoride
3) Die Oxidationsstufe von Metallen ist immer positiv.
Für Metalle der Hauptuntergruppen der ersten drei Gruppen Mit. Ö. Konstante:
Metalle der Gruppe IA - p. Ö. = +1,
Metalle der Gruppe IIA - p. Ö. = +2,
Metalle der Gruppe IIIA - p. Ö. = +3.
4) Für freie Atome und einfache Substanzen p. Ö. = 0.
5) Summe s. Ö. alle Elemente in der Verbindung = 0.
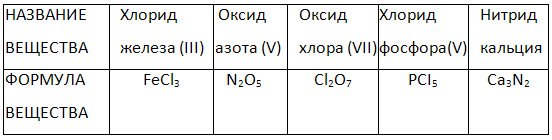
2. Methode der Namensbildung zweielementige (binäre) Verbindungen.

4. Füllen Sie die Tabelle „Namen und Formeln binärer Verbindungen“ aus.
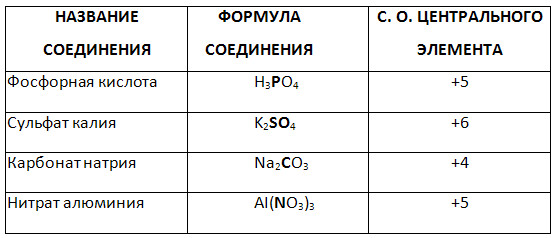
5. Bestimmen Sie den Oxidationsgrad des markierten Elements der Komplexverbindung.
Teil II
1. Bestimmen Sie die Oxidationsstufen chemischer Elemente in Verbindungen nach ihren Formeln. Schreiben Sie die Namen dieser Substanzen auf.

2. Getrennte Stoffe FeO, Fe2O3, CaCl2, AlBr3, CuO, K2O, BaCl2, SO3in zwei Gruppen. Notieren Sie die Namen der Substanzen und geben Sie den Oxidationsgrad an.

3. Stellen Sie eine Entsprechung zwischen dem Namen und der Oxidationsstufe eines Atoms eines chemischen Elements und der Formel der Verbindung her.

4. Machen Sie Formeln von Substanzen nach Namen.

5. Wie viele Moleküle sind in 48 g Schwefeloxid (IV) enthalten?
6. Erstellen Sie mithilfe des Internets und anderer Informationsquellen einen Bericht über die Verwendung einer binären Verbindung gemäß dem folgenden Plan:
1) Formel;
2) Name;
3) Eigenschaften;
4) Anwendung.
H2O Wasser, Wasserstoffoxid.
Wasser bei normale Bedingungen flüssig, farblos, geruchlos, in einer dicken Schicht - blau. Der Siedepunkt liegt bei etwa 100⁰С. Es ist ein gutes Lösungsmittel. Ein Wassermolekül besteht aus zwei Wasserstoffatomen und einem Sauerstoffatom, das ist seine qualitative und quantitative Zusammensetzung. Dies ist eine komplexe Substanz, sie ist durch Folgendes gekennzeichnet Chemische Eigenschaften: Wechselwirkung mit Alkalimetallen, Erdalkalimetallen. Austauschreaktionen mit Wasser nennt man Hydrolyse. Diese Reaktionen haben sehr wichtig in Chemie.
7. Der Oxidationszustand von Mangan in der K2MnO4-Verbindung ist:
3) +6
8. Chrom hat die niedrigste Oxidationsstufe in einer Verbindung, deren Formel lautet:
1) Cr2O3
9. Chlor weist die maximale Oxidationsstufe in einer Verbindung auf, deren Formel lautet:
3) Cl2O7
Wie bestimmt man den Oxidationsgrad? Das Periodensystem ermöglicht es Ihnen, einen bestimmten quantitativen Wert für jedes chemische Element aufzuzeichnen.
Definition
Versuchen wir zunächst zu verstehen, was dieser Begriff ist. Die Oxidationsstufe nach dem Periodensystem ist die Anzahl der Elektronen, die ein Element im Prozess der chemischen Wechselwirkung aufnimmt oder abgibt. Es kann sowohl negative als auch positive Werte annehmen.
Link zur Tabelle
Wie wird der Oxidationszustand bestimmt? Das Periodensystem besteht aus acht vertikal angeordneten Gruppen. Jeder von ihnen hat zwei Untergruppen: Haupt- und Nebengruppen. Um Indikatoren für Elemente zu setzen, müssen bestimmte Regeln verwendet werden.
Anweisung
Wie berechnet man die Oxidationsstufen von Elementen? Die Tabelle ermöglicht es Ihnen, ein ähnliches Problem vollständig zu bewältigen. Alkalimetalle, die in der ersten Gruppe (Hauptuntergruppe) angesiedelt sind, zeigen in Verbindungen die Oxidationsstufe, sie entspricht +, ist gleich ihrer höchsten Wertigkeit. Metalle der zweiten Gruppe (Untergruppe A) haben die Oxidationsstufe +2.
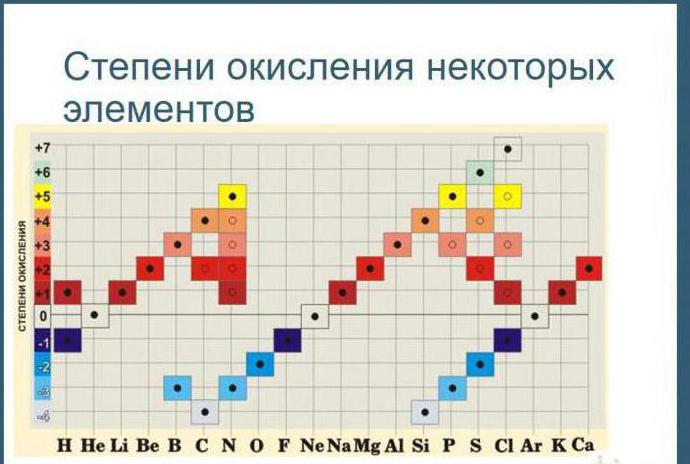
Anhand der Tabelle können Sie diesen Wert nicht nur für Elemente mit metallischen Eigenschaften, sondern auch für Nichtmetalle ermitteln. Ihr Maximalwert entspricht der höchsten Wertigkeit. Für Schwefel ist es beispielsweise +6, für Stickstoff +5. Wie wird ihre minimale (niedrigste) Zahl berechnet? Auch diese Frage beantwortet die Tabelle. Subtrahieren Sie die Gruppennummer von acht. Für Sauerstoff ist es beispielsweise -2, für Stickstoff -3.
Bei einfachen Stoffen, die keine chemische Wechselwirkung mit anderen Stoffen eingegangen sind, gilt der ermittelte Indikator als Null.
Versuchen wir, die Hauptwirkungen im Zusammenhang mit der Anordnung in binären Verbindungen zu identifizieren. Wie kann man den Oxidationsgrad eingeben? Das Periodensystem hilft bei der Lösung des Problems.
Nehmen Sie zum Beispiel Calciumoxid CaO. Für Kalzium, das sich in der Hauptuntergruppe der zweiten Gruppe befindet, ist der Wert konstant und beträgt +2. Für Sauerstoff, der nichtmetallische Eigenschaften hat, ist dieser Indikator ein negativer Wert und entspricht -2. Um die Korrektheit der Definition zu überprüfen, fassen wir die erhaltenen Zahlen zusammen. Als Ergebnis erhalten wir Null, daher sind die Berechnungen korrekt.
Lassen Sie uns ähnliche Indikatoren in einer weiteren binären Verbindung CuO bestimmen. Da Kupfer in einer sekundären Untergruppe (erste Gruppe) angesiedelt ist, kann der untersuchte Indikator daher zeigen unterschiedliche Bedeutungen. Um es zu bestimmen, müssen Sie daher zuerst den Indikator für Sauerstoff identifizieren.
Für ein Nichtmetall, das am Ende einer binären Formel steht, hat die Oxidationsstufe einen negativen Wert. Da sich dieses Element in der sechsten Gruppe befindet, erhalten wir beim Subtrahieren von sechs von acht, dass die Oxidationsstufe von Sauerstoff -2 entspricht. Da die Verbindung keine Indizes enthält, ist der Oxidationszustand von Kupfer positiv, gleich +2.
Wie wird die Chemietabelle sonst verwendet? Die Oxidationsstufen von Elementen in Formeln, die aus drei Elementen bestehen, werden ebenfalls nach einem bestimmten Algorithmus berechnet. Zunächst werden diese Indikatoren am ersten und letzten Element platziert. Zum ersten hat dieser Indikator einen positiven Wert, der der Wertigkeit entspricht. Für das extreme Element, das ein Nichtmetall ist, hat dieser Indikator einen negativen Wert, er wird als Differenz bestimmt (die Gruppennummer wird von acht abgezogen). Bei der Berechnung des Oxidationszustands des zentralen Elements wird eine mathematische Gleichung verwendet. Die Berechnungen berücksichtigen die für jedes Element verfügbaren Indizes. Die Summe aller Oxidationsstufen muss Null sein.
Bestimmungsbeispiel in Schwefelsäure
Die Formel dieser Verbindung ist H 2 SO 4 . Wasserstoff hat eine Oxidationsstufe von +1, Sauerstoff hat -2. Um den Oxidationszustand von Schwefel zu bestimmen, stellen wir eine mathematische Gleichung auf: + 1 * 2 + X + 4 * (-2) = 0. Wir erhalten, dass der Oxidationszustand von Schwefel +6 entspricht.
Abschluss
Wenn Sie die Regeln verwenden, können Sie die Koeffizienten in Redoxreaktionen anordnen. Dieses Thema wird im Kurs Chemie der neunten Klasse des Schullehrplans behandelt. Darüber hinaus ermöglichen Ihnen die Angaben zu den Oxidationsgraden die Erledigung der Aufgaben der OGE und der Einheitlichen Staatsprüfung.
Der Oxidationsgrad. Bestimmung der Oxidationsstufe eines Atoms eines Elements durch die chemische Formel der Verbindung. Zusammenstellung der Formel der Verbindung nach den bekannten Oxidationsstufen der Atome der Elemente
Die Oxidationsstufe eines Elements ist die bedingte Ladung eines Atoms in einer Substanz, berechnet unter der Annahme, dass sie aus Ionen besteht. Um den Oxidationsgrad von Elementen zu bestimmen, müssen bestimmte Regeln beachtet werden:
1. Der Oxidationszustand kann positiv, negativ oder null sein. Es ist bezeichnet Arabische Zahl mit einem Plus- oder Minuszeichen über dem Elementsymbol.
2. Bei der Bestimmung der Oxidationsstufen gehen sie von der Elektronegativität der Substanz aus: Die Summe der Oxidationsstufen aller Atome in der Verbindung ist Null.
3. Wenn die Verbindung aus Atomen eines Elements (in einer einfachen Substanz) besteht, ist die Oxidationsstufe dieser Atome Null.
4. Atomen einiger chemischer Elemente werden üblicherweise Oxidationsstufen von Stahl zugeordnet. Beispielsweise ist die Oxidationsstufe von Fluor in Verbindungen immer -1; Lithium, Natrium, Kalium, Rubidium und Cäsium +1; Magnesium, Calcium, Strontium, Barium und Zink +2, Aluminium +3.
5. Die Oxidationsstufe von Wasserstoff ist in den meisten Verbindungen +1 und nur in Verbindungen mit einigen Metallen gleich -1 (KH, BaH 2).
6. Die Oxidationsstufe von Sauerstoff ist in den meisten Verbindungen -2, und nur in einigen Verbindungen wird ihm eine Oxidationsstufe von -1 (H 2 O 2 , Na 2 O 2 oder +2 (OF 2)) zugeordnet.
7. Atome vieler chemischer Elemente weisen unterschiedliche Oxidationsstufen auf.
8. Die Oxidationsstufe eines Metallatoms in Verbindungen ist positiv und numerisch gleich seiner Wertigkeit.
9. Die maximale positive Oxidationsstufe eines Elements ist normalerweise gleich der Gruppennummer im Periodensystem, in dem sich das Element befindet.
10. Die minimale Oxidationsstufe für Metalle ist Null. Bei Nichtmetallen ist die niedrigere negative Oxidationsstufe in den meisten Fällen gleich der Differenz zwischen der Gruppenzahl und der Zahl acht.
11. Die Oxidationsstufe eines Atoms bildet ein einfaches Ion (besteht aus einem Atom), gleich der Ladung dieses Ions.
Anhand der obigen Regeln bestimmen wir die Oxidationsstufen chemischer Elemente in der Zusammensetzung von H 2 SO 4. Dies ist eine komplexe Substanz, die aus drei chemischen Elementen besteht - Wasserstoff H, Schwefel S und Sauerstoff O. Wir notieren die Oxidationsstufen der Elemente, für die sie konstant sind. In unserem Fall sind dies Wasserstoff H und Sauerstoff O:.
Lassen Sie uns die unbekannte Oxidationsstufe von Schwefel bestimmen. Der Oxidationszustand des Schwefels in dieser Verbindung sei x:.
Stellen wir Gleichungen auf, indem wir für jedes Element seinen Index mit dem Oxidationszustand multiplizieren und die extrahierte Menge mit Null gleichsetzen: 2 (+1) + x + 4 (-2) = 0
Daher ist die Oxidationsstufe von Schwefel plus sechs:.
Im folgenden Beispiel erfahren wir, wie Sie mit eine zusammengesetzte Formel schreiben können bekannte Abschlüsse Oxidation von Elementatomen. Machen wir die Formel von Eisen(III)-oxid. Das Wort "Oxid" bedeutet, dass rechts neben dem Symbol für Eisen das Symbol für Sauerstoff stehen sollte: FeO.
Beachten Sie die Oxidationsstufen chemischer Elemente über ihren Symbolen. Die Oxidationsstufe von Eisen ist im Namen in Klammern (III) angegeben, daher ist sie gleich +3, die Oxidationsstufe von Sauerstoff in Oxiden ist -2:.
Lassen Sie uns das kleinste gemeinsame Vielfache für die Zahlen 3 und 2 finden, das ist 6. Teilen Sie die Zahl 6 durch 3, wir erhalten die Zahl 2 - das ist der Index für Eisen. Teilen Sie die Zahl 6 durch 2, wir erhalten die Zahl 3 - das ist der Index für Sauerstoff:.
Lassen Sie uns im folgenden Beispiel herausfinden, wie man eine Verbindungsformel mit bekannten Oxidationsstufen von Elementatomen und Ionenladungen formuliert. Machen wir eine Formel aus Calciumorthophosphat. Das Wort "Orthophosphat" bedeutet, dass rechts neben dem Calcium-Symbol der Säurerest der Orthophosphatsäure geschrieben werden sollte: CaPO 4.
Beachten Sie den Oxidationszustand von Calcium (Regel Nummer vier) und die Ladung des Säurerests (gemäß der Löslichkeitstabelle):
Lassen Sie uns das kleinste gemeinsame Vielfache für die Zahlen 2 und 3 finden, das ist 6. Teilen Sie die Zahl 6 durch 2, wir erhalten die Zahl 3 - das ist der Index für Kalzium. Teilen Sie die Zahl 6 durch 3, wir erhalten die Zahl 2 – das ist der Index für den Säurerest:.
Kristallgitter
Kristallgitter. Atomare, molekulare und ionische Kristalle. Abhängigkeit der physikalischen Eigenschaften von Stoffen von der Art der Kristallgitter
In kristallinen Substanzen sind Atome, Moleküle und Ionen in bestimmten Abständen geordnet angeordnet. Eine solche regelmäßige Anordnung von Teilchen in Kristallen nennt man Kristallgitter. Je nachdem, welche Teilchen sich in den Knoten dieses Gitters befinden, werden ionische, atomare und molekulare Kristallgitter unterschieden. Auch metallische Kristallgitter sind bekannt.
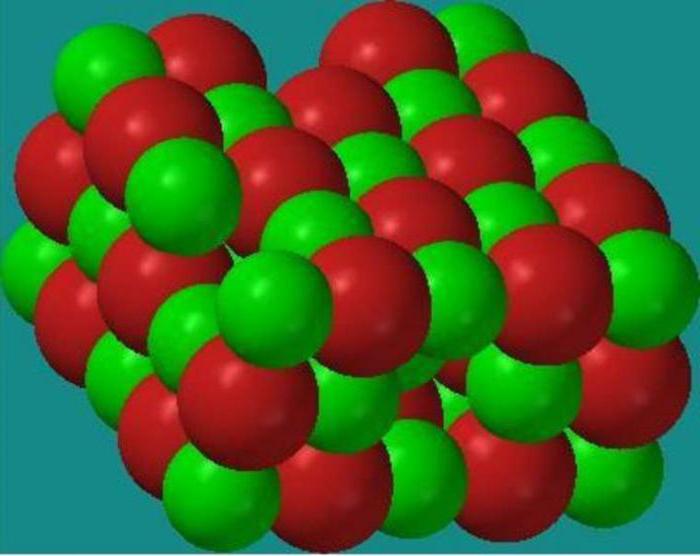
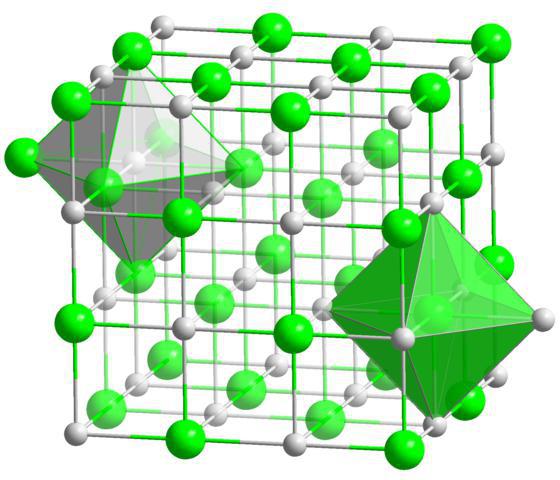
Ionenkristallgitter sind charakteristisch für Verbindungen mit ionischer chemischer Bindung. An den Stellen solcher Gitter befinden sich entgegengesetzt geladene Ionen. Die Kräfte der interionischen Wechselwirkung sind sehr bedeutend, daher sind Substanzen mit dieser Art von Kristallgitter nicht flüchtig, fest, feuerfest, ihre Lösungen und Schmelzen leiten elektrischen Strom. Typische Vertreter solche Verbindungen sind Salze, beispielsweise Natriumchlorid, Kaliumnitrat und andere.
Atomare Kristallgitter sind charakteristisch für Verbindungen mit kovalenter Art der chemischen Bindung. An den Stellen solcher Gitter befinden sich einzelne Atome, die durch kovalente Bindungen gebunden sind. Alle Bindungen sind gleich und stark, daher zeichnen sich Substanzen mit dieser Art von Kristallgitter durch eine hohe Härte aus, hohe Temperaturen Schmelzen, chemische Trägheit. Diese Art von Kristallgitter ist typisch für Diamant, Silizium(IV)-oxid, Bor.
Molekülkristallgitter sind charakteristisch für Verbindungen mit kovalenter chemischer Bindung. Die Stellen solcher Gitter enthalten unpolare oder polare Moleküle. Aufgrund schwacher Wechselwirkungskräfte haben Substanzen mit dieser Art von Kristallgitter eine geringe Härte, niedrige Schmelz- und Siedepunkte und sind durch Flüchtigkeit gekennzeichnet. Diese Art von Kristallgitter ist typisch für Sauerstoff, Jod, Wasser, Glucose, Alkohole, Naphthalin.
Es besteht also eine gewisse Beziehung zwischen der Art des Kristallgitters und physikalische Eigenschaften Substanzen. Wenn also die Struktur eines Stoffes bekannt ist, können seine Eigenschaften vorhergesagt werden, und umgekehrt, wenn die Eigenschaften eines Stoffes bekannt sind, dann kann seine Struktur bestimmt werden.
Kovalente Bindung, ihre Typen - polar und unpolar
Kovalente Bindung, ihre Typen - polar und unpolar. Bildung einer kovalenten unpolaren Bindung. Bildung einer kovalenten polaren Bindung. Elektronische Formeln von Stoffmolekülen
kovalente Bindung ist eine chemische Bindung, die durch gemeinsame Nutzung von Elektronenpaaren gebildet wird.
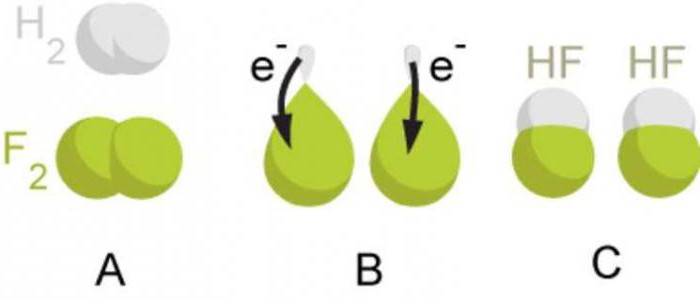
Betrachten wir den Mechanismus der Bildung einer kovalenten Bindung am Beispiel eines Wasserstoffmoleküls H 2 . Wasserstoffatome haben eine elektronische Formel: 1 H 1s 1 .
Wenn sich zwei Wasserstoffatome annähern, interagieren zwei Elektronen mit antiparallelem Spin (Elektronen sind durch Pfeile aus unterschiedlichen Richtungen gekennzeichnet) unter Bildung eines gemeinsamen (gemeinsamen) Elektronenpaares.
Das Schema für die Bildung einer kovalenten Bindung kann dargestellt werden, indem das ungepaarte Elektron der äußeren Ebene mit einem Punkt und das gemeinsame Elektronenpaar mit zwei Punkten bezeichnet wird. Ein gemeinsames Elektronenpaar, d.h. kovalente Bindung, oft durch einen Balken gekennzeichnet. Durch die Überlappung der s-Orbitale von Wasserstoffatomen entsteht ein gemeinsames Elektronenpaar, während im Bereich der überlappenden Orbitale eine erhöhte Elektronendichte entsteht.
Betrachten Sie die Bildung einer kovalenten Bindung in einem Chlor-Cl2-Molekül. Chloratome haben eine elektronische Formel: 17 Cl 1s 2 2s 2 2p 6 3s 2 3p 5.
Das Chloratom hat sieben Elektronen in seinem äußeren Energieniveau, mit einem ungepaarten Elektron in den 3p-Unterniveaus. Wenn zwei Chloratome zusammengebracht werden, überlappen 3p-Orbitale mit ungepaarten Elektronen und es entsteht ein gemeinsames Elektronenpaar. Jedes Chloratom im Cl 2 -Molekül speichert drei freie Elektronenpaare (die zu einem Atom gehören).
Im Wasserstoffmolekül H2 wird wie im Chlormolekül Cl 2 eine einfache (Einfach-)Bindung gebildet. Es gibt Moleküle, bei denen zwischen zwei Atomen zwei oder drei Elektronenpaare auftreten. Solche kovalenten Bindungen werden Doppel- bzw. Dreifachbindungen genannt. Der gebräuchliche Name für Doppel- und Dreifachbindungen ist Mehrfachbindungen.
Betrachten wir zum Beispiel die Bildung einer kovalenten Bindung im Sauerstoffmolekül O 2 . Sauerstoffatome haben eine elektronische Formel: 8 O 1s 2 2s 2 2p 4 .
Das Sauerstoffatom hat sechs Elektronen in seinem äußeren Energieniveau, mit zwei ungepaarten Elektronen in den 2p-Unterniveaus. An der Bildung einer chemischen Bindung im O 2 -Molekül sind zwei Elektronen jedes Sauerstoffatoms beteiligt. IN dieser Fall es entstehen zwei gemeinsame Elektronenpaare (Doppelbindung). Jedes Sauerstoffatom im O 2 -Molekül speichert zwei freie Elektronenpaare.
Wenn in einem Wasserstoffmolekül eine kovalente Bindung gebildet wird, ist jedes der Wasserstoffatome aufgrund der Bildung eines gemeinsamen Elektronenpaars eine stabile Zwei-Elektronen-Konfiguration. In anderen Fällen, wenn beispielsweise in den Molekülen von Chlor und Sauerstoff eine kovalente Bindung gebildet wird, ist jedes der Atome eine stabile Konfiguration, die aus acht Elektronen besteht.
Bei allen drei betrachteten Molekülen (Wasserstoff, Chlor und Sauerstoff) wurde eine kovalente Bindung zwischen Atomen mit gleicher Elektronegativität gebildet. Eine solche Wechselwirkung wird bei der Bildung einfacher nichtmetallischer Substanzen beobachtet, deren Moleküle aus zwei identischen Atomen bestehen. In diesem Fall befinden sich gemeinsame Elektronenpaare symmetrisch zwischen den Atomkernen, sie sind verbunden. Dadurch entstehen Moleküle, bei denen die Zentren positiver und negativer Ladungen zusammenfallen.
Eine kovalente Bindung, die aufgrund gemeinsamer Elektronenpaare zwischen Atomen mit gleicher Elektronegativität gebildet wird, wird als kovalente unpolare Bindung bezeichnet. Es muss daran erinnert werden, dass diese Art der chemischen Bindung in einfachen nichtmetallischen Substanzen gebildet wird. Als Beispiele für Substanzen mit kovalent unpolarer Bindungsart seien Fluor F 2, Brom Br 2, Jod I 2, Stickstoff N 2 genannt.
Wenn die wechselwirkenden Atome unterschiedliche Elektronegativität haben (Atome verschiedener chemischer Elemente), verschiebt sich das gemeinsame Elektronenpaar in Richtung des Atoms mit der größeren Elektronegativität. Dabei entsteht an einem Atom mit höherer Elektronegativität eine negative Teilladung und an einem Atom mit niedrigerer Elektronegativität eine positive Teilladung. Diese Teilladungen sind im absoluten Wert kleiner als eins.
Wenn beispielsweise ein Chlorwasserstoffmolekül HCl gebildet wird, überlappen das s-Orbital des Wasserstoffatoms und das p-Orbital des Chloratoms. Das gemeinsame Elektronenpaar ist asymmetrisch in Bezug auf die Zentren der wechselwirkenden Atome angeordnet. Es verschiebt sich zum elektronegativeren Chlor. Das Chloratom hat eine teilweise negative Ladung und das Wasserstoffatom hat eine teilweise positive Ladung. In diesem Fall fallen die Zentren positiver und negativer Ladungen im Molekül nicht zusammen. Solche Moleküle werden polar oder Dipole genannt. Ein Dipol ist ein System aus zwei Ladungen mit gleichem Betrag, aber entgegengesetztem Vorzeichen.
Eine kovalente Bindung, die zwischen Atomen gebildet wird, deren Elektronegativität sich nur geringfügig unterscheidet, wird als kovalente polare Bindung bezeichnet. Es muss daran erinnert werden, dass diese Art von chemischer Bindung in komplexen Substanzen gebildet wird, die aus Nichtmetallatomen bestehen. Als Beispiele für Substanzen mit kovalent polarer Bindungsart seien Fluorwasserstoff HF, Wasser H 2 O, Ammoniak NH 3, Methan CH 4, Kohlen(IV)oxid CO 2 genannt.
Eine Ionenbindung entsteht durch die vollständige Übertragung eines oder mehrerer Elektronen von einem Atom auf ein anderes. Diese Art der Bindung ist nur zwischen Atomen von Elementen möglich, deren Elektronegativität sich signifikant unterscheidet. Dabei wandert ein Elektron von einem Atom mit geringerer Elektronegativität zu einem Atom mit höherer Elektronegativität. Es muss daran erinnert werden, dass diese Art von chemischer Bindung zwischen den Atomen von Metallen und Nichtmetallen gebildet wird. Zum Beispiel Elemente der ersten und zweiten Gruppe von Hauptuntergruppen Periodensystem(typische Metalle) werden direkt mit Elementen der sechsten und siebten Gruppe der Hauptnebengruppen des Periodensystems (typische Nichtmetalle) kombiniert.
Betrachten wir den Mechanismus der Bildung einer Ionenbindung in der Zusammensetzung von Kaliumchlorid. Das Kaliumatom enthält ein Valenzelektron (bestimmt durch die Nummer der Gruppe, in der sich Kalium befindet). Das Chloratom enthält sieben Valenzelektronen (bestimmt durch die Nummer der Gruppe, in der sich Chlor befindet). Wenn Kaliumatome mit Chloratomen interagieren, gelangt das Valenzelektron des Kaliumatoms vollständig auf die äußere Ebene des Chloratoms und vervollständigt es in einer Acht-Elektronen-Struktur. In diesem Fall erhält das Kaliumatom, das ein Elektron verliert, eine positive Ladung +1 und verwandelt sich in ein K + -Kation, und das Chloratom, das ein Elektron hinzufügt, erhält eine negative Ladung -1 und verwandelt sich in ein Anion Cl - . Durch elektrostatische Kräfte werden entgegengesetzt geladene Ionen angezogen und es entsteht die Verbindung Kaliumchlorid. Dieser Prozess kann durch ein Diagramm dargestellt werden:
Nur einige chemische Elemente (Edelgase) befinden sich unter normalen Bedingungen im Zustand eines einatomigen Gases. Atome anderer Elemente hingegen existieren nicht einzeln, sondern sind Teil von Molekülen oder Kristallgittern, die durch eine Kombination von Atomen gebildet werden. Es gibt also einen Grund, warum sich Atome miteinander verbinden. Dieser Grund ist eine chemische Bindung, da zwischen den Atomen bestimmte elektrostatische Kräfte bestehen, die die Atome aneinander halten können. Es wurde nachgewiesen, dass bei der Bildung einer chemischen Bindung zwischen Atomen Hauptrolle gehört zu den Valenzelektronen (Elektronen der äußeren Ebene, die schwach mit dem Kern assoziiert sind).
Nach der Theorie der chemischen Bindung haben äußere Schalen, die aus zwei oder acht Elektronen bestehen, die größte Festigkeit. Die Edelgase haben solche Elektronenhüllen. Aus diesem Grund gehen Edelgase unter normalen Bedingungen keine chemischen Reaktionen mit anderen Elementen ein. Atome mit weniger als acht (oder zwei) Elektronen in ihrer äußeren Ebene versuchen, Edelgasstrukturen anzunehmen. Wenn also im Verlauf einer chemischen Reaktion ein Molekül entsteht, versuchen Atome, eine stabile Acht-Elektronen- oder Zwei-Elektronen-Hülle einzunehmen.
Die Bildung einer stabilen elektronischen Konfiguration kann auf verschiedene Weise erfolgen und zur Bildung von Molekülen oder nichtmolekularen Verbindungen verschiedener Strukturen führen. Als Ergebnis werden kovalente und ionische Typen chemischer Bindungen unterschieden. Zusätzlich zu diesen Arten gibt es noch andere Arten von chemischen Bindungen: metallisch und Wasserstoff (intermolekular).
Die Formalladung eines Atoms in Verbindungen ist eine Hilfsgröße, sie wird üblicherweise in der Beschreibung der Eigenschaften von Elementen in der Chemie verwendet. Diese bedingte elektrische Ladung ist der Oxidationsgrad. Sein Wert ändert sich durch viele chemische Prozesse. Obwohl die Ladung formal ist, charakterisiert sie anschaulich die Eigenschaften und das Verhalten von Atomen in Redoxreaktionen (ORDs).
Oxidation und Reduktion
Früher verwendeten Chemiker den Begriff „Oxidation“, um die Wechselwirkung von Sauerstoff mit anderen Elementen zu beschreiben. Der Name der Reaktionen kommt vom lateinischen Namen für Sauerstoff - Oxygenium. Später stellte sich heraus, dass auch andere Elemente oxidieren. In diesem Fall werden sie wiederhergestellt - sie binden Elektronen an. Jedes Atom verändert während der Bildung eines Moleküls die Struktur seiner Valenzelektronenhülle. In diesem Fall tritt eine formale Ladung auf, deren Wert von der Anzahl der bedingt abgegebenen oder aufgenommenen Elektronen abhängt. Zur Charakterisierung dieses Wertes wurde früher der englische chemische Begriff „Oxidation Number“ verwendet, was übersetzt „Oxidationszahl“ bedeutet. Dabei gehen sie davon aus, dass die Bindungselektronen in Molekülen oder Ionen zu einem Atom gehören, das mehr hat hochwertig Elektronegativität (EO). Die Fähigkeit, ihre Elektronen zu behalten und sie von anderen Atomen anzuziehen, kommt in starken Nichtmetallen (Halogenen, Sauerstoff) gut zum Ausdruck. Starke Metalle (Natrium, Kalium, Lithium, Calcium, andere Alkali- und Erdalkalielemente) haben entgegengesetzte Eigenschaften.
Bestimmung des Oxidationsgrades
Die Oxidationsstufe ist die Ladung, die ein Atom annehmen würde, wenn die an der Bindungsbildung beteiligten Elektronen vollständig zu einem elektronegativeren Element verschoben würden. Es gibt Substanzen, die keine Molekularstruktur haben (Alkalimetallhalogenide und andere Verbindungen). In diesen Fällen stimmt die Oxidationsstufe mit der Ladung des Ions überein. Die bedingte oder reale Ladung zeigt, welcher Prozess stattgefunden hat, bevor die Atome ihren aktuellen Zustand erreichten. Ein positiver Oxidationszustand ist die Gesamtzahl der Elektronen, die von den Atomen entfernt wurden. Negative Bedeutung die Oxidationsstufe ist gleich der Anzahl der aufgenommenen Elektronen. Indem man den Oxidationszustand eines chemischen Elements ändert, beurteilt man, was mit seinen Atomen während der Reaktion passiert (und umgekehrt). Die Farbe der Substanz bestimmt, welche Änderungen im Oxidationszustand aufgetreten sind. Verbindungen von Chrom, Eisen und einer Reihe anderer Elemente, in denen sie unterschiedliche Wertigkeiten aufweisen, sind unterschiedlich gefärbt.
Negative, null und positive Oxidationszustandswerte

Es entstehen einfache Substanzen chemische Elemente Mit den gleichen Wert EO. In diesem Fall gehören die Bindungselektronen allen Strukturteilchen gleichermaßen. Daher ist bei einfachen Substanzen die Oxidationsstufe (H 0 2, O 0 2, C 0) nicht charakteristisch für die Elemente. Wenn Atome Elektronen aufnehmen oder sich die allgemeine Wolke in ihre Richtung verschiebt, ist es üblich, Ladungen mit einem Minuszeichen zu schreiben. Zum Beispiel F-1, O-2, C-4. Durch die Abgabe von Elektronen erhalten Atome eine reale oder formale positive Ladung. Im OF 2 -Oxid gibt das Sauerstoffatom jeweils ein Elektron an zwei Fluoratome ab und befindet sich in der Oxidationsstufe O +2. Es wird angenommen, dass in einem Molekül oder einem mehratomigen Ion die elektronegativeren Atome alle Bindungselektronen erhalten.
Schwefel ist ein Element, das unterschiedliche Wertigkeiten und Oxidationsstufen aufweist.
Chemische Elemente der Hauptuntergruppen weisen oft eine niedrigere Wertigkeit gleich VIII auf. Beispielsweise ist die Wertigkeit von Schwefel in Schwefelwasserstoff und Metallsulfiden II. Das Element ist durch mittlere und höhere Wertigkeiten im angeregten Zustand gekennzeichnet, wenn das Atom ein, zwei, vier oder alle sechs Elektronen abgibt und die Wertigkeiten I, II, IV bzw. VI aufweist. Die gleichen Werte, nur mit Minus- oder Pluszeichen, haben die Oxidationsstufen von Schwefel:
- in Fluorsulfid gibt ein Elektron: -1;
- in Schwefelwasserstoff der niedrigste Wert: -2;
- im Dioxid-Zwischenzustand: +4;
- in Trioxid, Schwefelsäure und Sulfaten: +6.
In seiner höchsten Oxidationsstufe nimmt Schwefel nur Elektronen auf, in seiner niedrigsten Stufe zeigt es stark reduzierende Eigenschaften. Die S +4 -Atome können je nach Bedingungen als Reduktions- oder Oxidationsmittel in Verbindungen wirken.
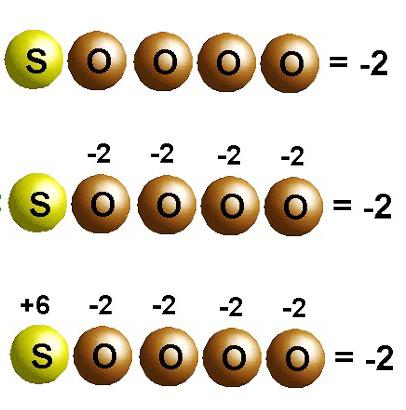
Übertragung von Elektronen bei chemischen Reaktionen
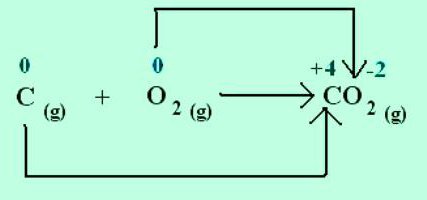
Bei der Bildung eines Natriumchloridkristalls gibt Natrium Elektronen an das elektronegativere Chlor ab. Die Oxidationsstufen der Elemente stimmen mit den Ladungen der Ionen überein: Na +1 Cl -1 . Für Moleküle, die durch Sozialisierung und Verdrängung von Elektronenpaaren zu einem elektronegativeren Atom entstehen, ist nur das Konzept einer formalen Ladung anwendbar. Es ist aber davon auszugehen, dass alle Verbindungen aus Ionen aufgebaut sind. Dann erhalten die Atome durch das Anziehen von Elektronen eine bedingte negative Ladung und durch das Abgeben eine positive. Geben Sie bei Reaktionen an, wie viele Elektronen verschoben werden. Beispielsweise zeigt im Kohlendioxidmolekül C +4 O - 2 2 der in der oberen rechten Ecke des chemischen Symbols für Kohlenstoff angegebene Index die Anzahl der aus dem Atom entfernten Elektronen an. Sauerstoff in dieser Substanz hat eine Oxidationsstufe von -2. Der entsprechende Index mit dem chemischen Zeichen O ist die Anzahl der hinzugefügten Elektronen im Atom.
Wie man Oxidationsstufen berechnet
Das Zählen der von Atomen gespendeten und hinzugefügten Elektronen kann zeitaufwändig sein. Die folgenden Regeln erleichtern diese Aufgabe:
- Bei einfachen Stoffen sind die Oxidationsstufen null.
- Die Summe der Oxidation aller Atome oder Ionen in einem neutralen Stoff ist Null.
- Bei einem komplexen Ion muss die Summe der Oxidationsstufen aller Elemente der Ladung des gesamten Teilchens entsprechen.
- Ein elektronegativeres Atom nimmt eine negative Oxidationsstufe an, die mit einem Minuszeichen geschrieben wird.
- Weniger elektronegative Elemente erhalten positive Oxidationsstufen, sie werden mit einem Pluszeichen geschrieben.
- Sauerstoff weist im Allgemeinen eine Oxidationsstufe von -2 auf.
- Für Wasserstoff charakteristischer Wert: +1, gefunden in Metallhydriden: H-1.
- Fluor ist das elektronegativste aller Elemente, seine Oxidationsstufe ist immer -4.
- Bei den meisten Metallen sind Oxidationszahlen und Wertigkeiten gleich.

Oxidationszustand und Wertigkeit
Die meisten Verbindungen entstehen durch Redoxprozesse. Der Übergang oder die Verschiebung von Elektronen von einem Element zum anderen führt zu einer Änderung ihrer Oxidationsstufe und Wertigkeit. Oft stimmen diese Werte überein. Als Synonym für den Begriff "Oxidationszustand" kann der Ausdruck "elektrochemische Wertigkeit" verwendet werden. Aber es gibt Ausnahmen, zum Beispiel im Ammoniumion ist Stickstoff vierwertig. Gleichzeitig befindet sich das Atom dieses Elements in der Oxidationsstufe -3. In organischen Stoffen ist Kohlenstoff immer vierwertig, aber die Oxidationsstufen des C-Atoms in Methan CH 4, Ameisenalkohol CH 3 OH und HCOOH-Säure haben unterschiedliche Werte: -4, -2 und +2.
Redoxreaktionen

Viele der Redox kritische Prozesse in Industrie, Technik, Wohnen u unbelebte Natur: Verbrennung, Korrosion, Fermentation, intrazelluläre Atmung, Photosynthese und andere Phänomene.
Bei der Erstellung der OVR-Gleichungen werden die Koeffizienten nach der Methode der elektronischen Waage ausgewählt, bei der die folgenden Kategorien verwendet werden:
- Oxidationsstufen;
- das Reduktionsmittel gibt Elektronen ab und wird oxidiert;
- das Oxidationsmittel nimmt Elektronen auf und wird reduziert;
- Die Anzahl der gegebenen Elektronen muss gleich der Anzahl der angehängten sein.
Die Aufnahme von Elektronen durch ein Atom führt zu einer Verringerung seiner Oxidationsstufe (Reduktion). Der Verlust eines oder mehrerer Elektronen durch ein Atom geht mit einer reaktionsbedingten Erhöhung der Oxidationszahl des Elements einher. Für OVR, das Fließen zwischen Ionen starker Elektrolyte in wässrigen Lösungen, wird häufiger nicht die elektronische Waage, sondern die Methode der Halbreaktionen verwendet.
Es könnte hilfreich sein zu lesen:
- Tag der heiligen Myrrhe tragenden Frauen;
- Träger der Leidenschaft Yevgeny Botkin Märtyrer Yevgeny Botkin;
- Sakraler Rap: Chuvash „Okhlobystin“ lehrt Teenager Liebe und Demut mit Rezitativen;
- Diözesan-Missionskurse: Vortrag über die Missionsarbeit von Protodeacon A;
- Wie man versteht, was ein Skorpion mag;
- Zombie-Apokalypse online mit Freunden;
- Spiele Online-Zombie-Apokalypse spielen;
- Probleme beim Starten des Fifa-Spiels;