როგორ გამოვთვალოთ ყველაზე დაბალი ჟანგვის მდგომარეობა. რა არის ჟანგვის ხარისხი? როგორ განვსაზღვროთ ელემენტების ჟანგვის მდგომარეობა?
ასეთი ნივთი სკოლის სასწავლო გეგმავინაიდან ქიმია უამრავ სირთულეს უქმნის თანამედროვე სკოლის მოსწავლეების უმეტესობას, ცოტას შეუძლია განსაზღვროს ნაერთებში დაჟანგვის ხარისხი. ყველაზე დიდი სირთულეები აქვთ სკოლის მოსწავლეებს, რომლებიც სწავლობენ არაორგანულ ქიმიას, ანუ საბაზო სკოლის მოსწავლეებს (8-9 კლასები). საგნის გაუგებრობა იწვევს მოსწავლეებში ამ საგნის მიმართ მტრობის გაჩენას.
მასწავლებლები ასახელებენ უამრავ მიზეზს საშუალო და საშუალო სკოლის მოსწავლეების ქიმიისადმი ასეთი „არ მოსწონთ“: რთული ქიმიური ტერმინების გაგების სურვილი, კონკრეტული პროცესის განხილვის ალგორითმების გამოყენების უუნარობა, მათემატიკური ცოდნის პრობლემები. რუსეთის ფედერაციის განათლების სამინისტრომ საგნის შინაარსში სერიოზული ცვლილებები შეიტანა. გარდა ამისა, „შემცირდა“ ქიმიის სწავლების საათების რაოდენობა. ამან უარყოფითი გავლენა მოახდინა საგნის ცოდნის ხარისხზე, დისციპლინის შესწავლისადმი ინტერესის შემცირებაზე.
ქიმიის კურსის რომელი თემებია ყველაზე რთული სკოლის მოსწავლეებისთვის?
ავტორი ახალი პროგრამასაბაზო სკოლის აკადემიური დისციპლინის "ქიმია" კურსი მოიცავს რამდენიმე სერიოზულ თემას: დ.ი. მენდელეევის ელემენტების პერიოდული ცხრილი, არაორგანული ნივთიერებების კლასები, იონური გაცვლა. მერვეკლასელებისთვის ყველაზე რთული ოქსიდების განსაზღვრაა.
განთავსების წესები
უპირველეს ყოვლისა, მოსწავლეებმა უნდა იცოდნენ, რომ ოქსიდები არის რთული ორელემენტიანი ნაერთები, რომლებიც შეიცავს ჟანგბადს. წინაპირობაორობითი ნაერთის ოქსიდების კლასს მიეკუთვნება ჟანგბადის მეორე ადგილი ამ ნაერთში.
მჟავა ოქსიდების ალგორითმი
დასაწყისისთვის, ჩვენ აღვნიშნავთ, რომ ჟანგვის მდგომარეობები არის ელემენტების ვალენტობის რიცხვითი გამოხატულება. ჩამოყალიბებულია არალითონებით ან ლითონებით, რომელთა ვალენტობაა ოთხიდან შვიდამდე, ასეთ ოქსიდებში მეორე აუცილებლად არის ჟანგბადი.
ოქსიდებში ჟანგბადის ვალენტობა ყოველთვის შეესაბამება ორს; ის შეიძლება განისაზღვროს D.I. მენდელეევის ელემენტების პერიოდული ცხრილიდან. ისეთი ტიპიური არალითონი, როგორიცაა ჟანგბადი, რომელიც იმყოფება პერიოდული ცხრილის მთავარი ქვეჯგუფის მე-6 ჯგუფში, იღებს ორ ელექტრონს, რათა სრულად დაასრულოს მისი გარე ენერგიის დონე. ჟანგბადის ნაერთებში არამეტალები ყველაზე ხშირად ავლენენ უფრო მაღალ ვალენტობას, რაც შეესაბამება თავად ჯგუფის რაოდენობას. მნიშვნელოვანია გავიხსენოთ, რომ ქიმიური ელემენტების ჟანგვის მდგომარეობა არის მაჩვენებელი, რომელიც გულისხმობს დადებით (უარყოფით) რიცხვს.
ფორმულის დასაწყისში არალითონს აქვს დადებითი დაჟანგვის მდგომარეობა. არალითონური ჟანგბადი ოქსიდებში სტაბილურია, მისი ინდექსია -2. მჟავა ოქსიდებში მნიშვნელობების განლაგების სანდოობის შესამოწმებლად, თქვენ მოგიწევთ გაამრავლოთ ყველა ის რიცხვი, რომელიც დააწესეთ კონკრეტული ელემენტის ინდექსებით. გამოთვლები ითვლება საიმედოდ, თუ მითითებული ხარისხების ყველა პლუსისა და მინუსების ჯამი არის 0.

ორ ელემენტიანი ფორმულების შედგენა
ელემენტების ატომების დაჟანგვის მდგომარეობა იძლევა ორი ელემენტისგან ნაერთების შექმნისა და ჩაწერის შანსს. ფორმულის შექმნისას, დამწყებთათვის, ორივე სიმბოლო იწერება გვერდიგვერდ, აუცილებლად დააყენეთ ჟანგბადი მეორე ადგილზე. თითოეული ჩაწერილი ნიშნის ზემოთ მითითებულია ჟანგვის მდგომარეობების მნიშვნელობები, შემდეგ ნაპოვნი რიცხვებს შორის არის რიცხვი, რომელიც იყოფა ორივე ციფრზე ნარჩენების გარეშე. ეს მაჩვენებელი ცალკე უნდა გაიყოს დაჟანგვის ხარისხის რიცხვითი მნიშვნელობით, მიიღება ინდექსები ორ ელემენტიანი ნივთიერების პირველი და მეორე კომპონენტებისთვის. უმაღლესი ჟანგვის მდგომარეობა რიცხობრივად უდრის ტიპიური არალითონის უმაღლესი ვალენტობის მნიშვნელობას, იდენტურია ჯგუფის რიცხვისა, სადაც არალითონი დგას PS-ში.
ძირითადი ოქსიდებში რიცხვითი მნიშვნელობების დაყენების ალგორითმი
ასეთ ნაერთებად ითვლება ტიპიური ლითონების ოქსიდები. მათ ყველა ნაერთში აქვთ ჟანგვის მდგომარეობის ინდექსი არაუმეტეს +1 ან +2. იმისათვის, რომ გაიგოთ, რა იქნება ლითონის ჟანგვის მდგომარეობა, შეგიძლიათ გამოიყენოთ პერიოდული ცხრილი. პირველი ჯგუფის ძირითადი ქვეჯგუფების ლითონებისთვის ეს პარამეტრი ყოველთვის მუდმივია, ის მსგავსია ჯგუფის ნომრის, ანუ +1.
მეორე ჯგუფის მთავარი ქვეჯგუფის ლითონებს ასევე ახასიათებთ სტაბილური დაჟანგვის მდგომარეობა, რიცხვით +2. ოქსიდების დაჟანგვის მდგომარეობები, მათი ინდექსების (რიცხვების) გათვალისწინებით, უნდა დაემატოს ნულს, ვინაიდან ქიმიური მოლეკულა ითვლება ნეიტრალურ, მუხტის გარეშე ნაწილაკად.
ჟანგბადის შემცველ მჟავებში ჟანგბადის მდგომარეობების განლაგება
მჟავები რთული ნივთიერებებია, რომლებიც შედგება ერთი ან მეტი წყალბადის ატომისგან, რომლებიც დაკავშირებულია მჟავას ნარჩენებთან. იმის გათვალისწინებით, რომ ჟანგვის მდგომარეობები რიცხვებია, მათი გამოსათვლელად საჭიროა მათემატიკის გარკვეული უნარები. მჟავებში წყალბადის (პროტონის) ასეთი მაჩვენებელი ყოველთვის სტაბილურია, ის არის +1. შემდეგი, თქვენ შეგიძლიათ მიუთითოთ ჟანგბადის მდგომარეობა უარყოფითი ჟანგბადის იონისთვის, ის ასევე სტაბილურია, -2.
მხოლოდ ამ მოქმედებების შემდეგ არის შესაძლებელი ფორმულის ცენტრალური კომპონენტის დაჟანგვის ხარისხის გამოთვლა. როგორც კონკრეტული ნიმუში, განიხილეთ ელემენტების ჟანგვის მდგომარეობის განსაზღვრა გოგირდმჟავაში H2SO4. იმის გათვალისწინებით, რომ ამ რთული ნივთიერების მოლეკულა შეიცავს წყალბადის ორ პროტონს, 4 ჟანგბადის ატომს, ვიღებთ ამ ფორმის გამოხატულებას +2+X-8=0. იმისათვის, რომ ჯამმა შექმნას ნული, გოგირდს ექნება ჟანგვის მდგომარეობა +6
ჟანგვის მდგომარეობების განლაგება მარილებში
მარილები არის რთული ნაერთები, რომლებიც შედგება ლითონის იონებისა და ერთი ან მეტი მჟავის ნარჩენებისგან. თითოეული მათგანის ჟანგვის მდგომარეობის განსაზღვრის მეთოდი შემადგენელი ნაწილებიკომპლექსურ მარილში იგივეა, რაც ჟანგბადის შემცველ მჟავებში. იმის გათვალისწინებით, რომ ელემენტების დაჟანგვის მდგომარეობა არის რიცხვითი მაჩვენებელი, მნიშვნელოვანია სწორად მიუთითოთ ლითონის ჟანგვის მდგომარეობა.
თუ მარილი წარმომქმნელი ლითონი მდებარეობს მთავარ ქვეჯგუფში, მისი დაჟანგვის მდგომარეობა იქნება სტაბილური, შეესაბამება ჯგუფის რიცხვს, არის დადებითი მნიშვნელობა. თუ მარილი შეიცავს PS-ის მსგავსი ქვეჯგუფის ლითონს, შესაძლებელია სხვადასხვა ლითონების ჩვენება მჟავა ნარჩენებით. ლითონის ჟანგვის მდგომარეობის დაყენების შემდეგ ჩადეთ (-2), შემდეგ ცენტრალური ელემენტის დაჟანგვის მდგომარეობა გამოითვლება ქიმიური განტოლების გამოყენებით.
მაგალითად, განვიხილოთ ელემენტების ჟანგვის მდგომარეობის განსაზღვრა (საშუალო მარილი). NaNO3. მარილს წარმოქმნის 1 ჯგუფის მთავარი ქვეჯგუფის მეტალი, შესაბამისად, ნატრიუმის ჟანგვის მდგომარეობა იქნება +1. ნიტრატებში ჟანგბადს აქვს ჟანგვის მდგომარეობა -2. დაჟანგვის ხარისხის რიცხვითი მნიშვნელობის დასადგენად არის განტოლება +1+X-6=0. ამ განტოლების ამოხსნით, მივიღებთ, რომ X უნდა იყოს +5, ეს არის

ძირითადი ტერმინები OVR-ში
როგორც ჟანგვითი, ასევე შემცირების პროცესისთვის, არსებობს სპეციალური ტერმინები, რომლებიც სტუდენტებს მოეთხოვებათ ისწავლონ.
ატომის დაჟანგვის მდგომარეობა არის მისი პირდაპირი უნარი, მიამაგროს (სხვებს) ელექტრონები ზოგიერთი იონიდან ან ატომიდან.
ნეიტრალური ატომები ან დამუხტული იონები განიხილება ჟანგვის აგენტად. ქიმიური რეაქციაელექტრონების მიღება.
შემცირების აგენტი იქნება დაუმუხტი ატომები ან დამუხტული იონები, რომლებიც ქიმიური ურთიერთქმედების პროცესში კარგავენ საკუთარ ელექტრონებს.
ოქსიდაცია წარმოდგენილია როგორც ელექტრონების დონაციის პროცედურა.
შემცირება დაკავშირებულია დამატებითი ელექტრონების მიღებასთან დაუმუხტველი ატომის ან იონის მიერ.
რედოქს პროცესს ახასიათებს რეაქცია, რომლის დროსაც ატომის ჟანგვის მდგომარეობა აუცილებლად იცვლება. ეს განმარტება საშუალებას გაძლევთ გაიგოთ, თუ როგორ შეგიძლიათ განსაზღვროთ არის თუ არა რეაქცია OVR.

OVR ანალიზის წესები
ამ ალგორითმის გამოყენებით თქვენ შეგიძლიათ მოაწყოთ კოეფიციენტები ნებისმიერ ქიმიურ რეაქციაში.
ბოლო ნაბიჯი იქნება სტერეოქიმიური კოეფიციენტების განლაგება განსახილველ რეაქციაში.
OVR მაგალითი
პირველ რიგში, თქვენ უნდა მოაწყოთ ჟანგვის მდგომარეობები თითოეულ ქიმიურ ნივთიერებაში. გაითვალისწინეთ, რომ ჟანგვის მდგომარეობა არის ნულოვანი, რადგან არ არსებობს უარყოფითი ნაწილაკების დაბრუნება (მიმაგრება). ორობით და სამელემენტიან ნივთიერებებში ჟანგვის მდგომარეობების განლაგების წესები ზემოთ ჩვენ განვიხილეთ.
შემდეგ თქვენ უნდა დაადგინოთ ის ატომები ან იონები, რომლებშიც ტრანსფორმაციის დროს შეიცვალა ჟანგვის მდგომარეობა.
დაწერილი განტოლების მარცხენა მხრიდან იზოლირებულია ატომები ან დამუხტული იონები, რომლებმაც შეცვალეს მათი დაჟანგვის მდგომარეობა. ეს აუცილებელია ბალანსისთვის. ელემენტების ზემოთ, მათი მნიშვნელობები უნდა იყოს მითითებული.
გარდა ამისა, რეაქციის დროს წარმოქმნილი ატომები ან იონები აღირიცხება + ნიშნით, ატომის მიერ მიღებული ელექტრონების რაოდენობა, - უარყოფითი ნაწილაკების რაოდენობა. თუ ურთიერთქმედების პროცესის შემდეგ ჟანგვის მდგომარეობა მცირდება. ეს ნიშნავს, რომ ელექტრონები მიღებულია ატომის (იონის) მიერ. ჟანგვის ხარისხის გაზრდით, ატომი (იონი) გამოყოფს ელექტრონებს რეაქციის დროს.
სულ მცირე საერთო რაოდენობაიყოფა ჯერ მიღებულ ელექტრონებზე, შემდეგ პროცესში გადაცემული ელექტრონებით, მიიღება კოეფიციენტები. ნაპოვნი ფიგურები იქნება სასურველი სტერეოქიმიური კოეფიციენტები.
განსაზღვრეთ ჟანგვის აგენტი, შემცირების აგენტი, რეაქციის დროს მიმდინარე პროცესები.
განვიხილოთ ამ ალგორითმის პრაქტიკული გამოყენება კონკრეტული ქიმიური რეაქციისთვის.
Fe+CuSO4=Cu+FeSO4
ჩვენ ვიანგარიშებთ ინდიკატორებს ყველა მარტივი და რთული ნივთიერებისთვის.
ვინაიდან Fe და Cu მარტივი ნივთიერებებია, მათი დაჟანგვის მდგომარეობა არის 0. CuSO4-ში, შემდეგ Cu + 2, შემდეგ ჟანგბადს აქვს -2, ხოლო გოგირდს აქვს +6. FeSO4-ში: Fe +2, შესაბამისად, O-2-ისთვის, S +6 გამოთვლების მიხედვით.
ახლა ჩვენ ვეძებთ ელემენტებს, რომლებსაც შეუძლიათ შეცვალონ ინდიკატორები, ჩვენს სიტუაციაში ისინი იქნება Fe და Cu.
ვინაიდან რეაქციის შემდეგ რკინის ატომის მნიშვნელობა +2 გახდა, რეაქციაში 2 ელექტრონი დათმო. სპილენძმა შეცვალა თავისი მაჩვენებლები +2-დან 0-მდე, შესაბამისად, სპილენძმა მიიღო 2 ელექტრონი. ახლა ჩვენ განვსაზღვრავთ მიღებული და მოცემული ელექტრონების რაოდენობას რკინის ატომით და ორვალენტიანი სპილენძის კატიონით. ტრანსფორმაციის დროს ორი ელექტრონი აიღო ორვალენტიანი სპილენძის კატიონმა და ამდენივე ელექტრონი გადასცა რკინის ატომს.
ამ პროცესში აზრი არ აქვს მინიმალური საერთო ჯერადის დადგენას, რადგან ტრანსფორმაციის დროს ელექტრონების თანაბარი რაოდენობა მიიღება და გადაეცემა. სტერეოქიმიური კოეფიციენტები ასევე შეესაბამება ერთიანობას. რეაქციაში რკინა აჩვენებს შემცირების აგენტის თვისებებს, ხოლო ის იჟანგება. ორვალენტიანი სპილენძის კატიონი მცირდება სუფთა სპილენძამდე, რეაქციაში, რომელიც მას აქვს უმაღლესი ხარისხიდაჟანგვა.

პროცესების გამოყენება
ჟანგვის მდგომარეობის ფორმულები უნდა იცოდეს ყველა მოსწავლემ 8-9 კლასებში, რადგან ეს საკითხი შედის OGE დავალებები. თამაშობს ნებისმიერი პროცესი, რომელიც მიმდინარეობს ჟანგვითი, შემცირების ნიშნებით მნიშვნელობაჩვენს ცხოვრებაში. მათ გარეშე ადამიანის ორგანიზმში მეტაბოლური პროცესები შეუძლებელია.
ნაწილი I
1. დაჟანგვის მდგომარეობა (ს. ო.) არისქიმიური ელემენტის ატომების პირობითი მუხტი რთულ ნივთიერებაში, გამოითვლება იმ ვარაუდის საფუძველზე, რომ იგი შედგება მარტივი იონებისგან.
Უნდა იცოდე!
1) კავშირებში. ო. წყალბადი = +1, გარდა ჰიდრიდების.
2) ნაერთებში. ო. ჟანგბადი = -2, გარდა პეროქსიდების ![]() და ფტორიდები
და ფტორიდები
3) ლითონების ჟანგვის მდგომარეობა ყოველთვის დადებითია.
პირველი სამი ჯგუფის ძირითადი ქვეჯგუფების ლითონებისთვის თან. ო. მუდმივი:
IA ჯგუფის ლითონები - გვ. ო. = +1,
ჯგუფი IIA ლითონები - გვ. ო. = +2,
IIIA ჯგუფის ლითონები - გვ. ო. = +3.
4) თავისუფალი ატომებისა და მარტივი ნივთიერებებისთვის გვ. ო. = 0.
5) სულ ს. ო. ნაერთში ყველა ელემენტი = 0.
2. სახელების ფორმირების მეთოდიორ ელემენტიანი (ორობითი) ნაერთები.

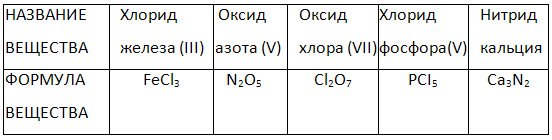
4. შეავსეთ ცხრილი „ორობითი ნაერთების სახელები და ფორმულები“.
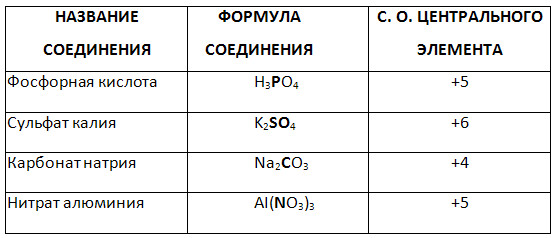
5. დაადგინეთ რთული ნაერთის გამოკვეთილი ელემენტის დაჟანგვის ხარისხი.
ნაწილი II
1. განსაზღვრეთ ქიმიური ელემენტების ჟანგვის მდგომარეობა ნაერთებში მათი ფორმულების მიხედვით. ჩაწერეთ ამ ნივთიერებების სახელები.

2. გამოყავით ნივთიერებები FeO, Fe2O3, CaCl2, AlBr3, CuO, K2O, BaCl2, SO3ორ ჯგუფად. ჩაწერეთ ნივთიერებების სახელები დაჟანგვის ხარისხის მითითებით.

3. დაადგინეთ შესაბამისობა ქიმიური ელემენტის ატომის სახელსა და ჟანგვის მდგომარეობასა და ნაერთის ფორმულას შორის.

4. დაასახელეთ ნივთიერებების ფორმულები.

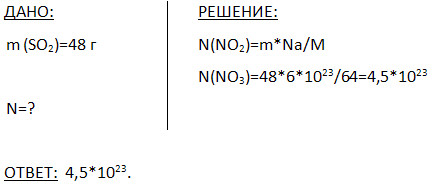
5. რამდენ მოლეკულას შეიცავს 48 გ გოგირდის ოქსიდი (IV)?
6. ინტერნეტისა და ინფორმაციის სხვა წყაროების გამოყენებით მოამზადეთ ანგარიში ნებისმიერი ორობითი კავშირის გამოყენების შესახებ შემდეგი გეგმის მიხედვით:
1) ფორმულა;
2) სახელი;
3) თვისებები;
4) განაცხადი.
H2O წყალი, წყალბადის ოქსიდი.
წყალი ზე ნორმალური პირობებითხევადი, უფერო, უსუნო, სქელ ფენაში - ლურჯი. დუღილის წერტილი არის დაახლოებით 100⁰С. კარგი გამხსნელია. წყლის მოლეკულა შედგება ორი წყალბადის ატომისა და ერთი ჟანგბადის ატომისგან, ეს არის მისი ხარისხობრივი და რაოდენობრივი შემადგენლობა. ეს არის რთული ნივთიერება, მას ახასიათებს შემდეგი ქიმიური თვისებები: ურთიერთქმედება ტუტე ლითონებთან, ტუტე მიწის ლითონებთან. წყალთან გაცვლის რეაქციებს ჰიდროლიზი ეწოდება. ეს რეაქციები აქვს დიდი მნიშვნელობაქიმიაში.
7. მანგანუმის ჟანგვის მდგომარეობა K2MnO4 ნაერთში არის:
3) +6
8. ქრომს აქვს ყველაზე დაბალი დაჟანგვის მდგომარეობა ნაერთში, რომლის ფორმულაა:
1) Cr2O3
9. ქლორი ავლენს მაქსიმალურ ჟანგვის მდგომარეობას ნაერთში, რომლის ფორმულაა:
3) Сl2O7
როგორ განვსაზღვროთ ჟანგვის ხარისხი? პერიოდული ცხრილი საშუალებას გაძლევთ ჩაწეროთ მოცემული რაოდენობრივი მნიშვნელობა ნებისმიერი ქიმიური ელემენტისთვის.
განმარტება
პირველ რიგში, შევეცადოთ გავიგოთ რა არის ეს ტერმინი. პერიოდული ცხრილის მიხედვით ჟანგვის მდგომარეობა არის ელექტრონების რაოდენობა, რომლებიც მიიღება ან გადაეცემა ელემენტს ქიმიური ურთიერთქმედების პროცესში. მას შეუძლია მიიღოს როგორც უარყოფითი, ასევე დადებითი მნიშვნელობები.
ბმული მაგიდასთან
როგორ განისაზღვრება ჟანგვის მდგომარეობა? პერიოდული ცხრილი შედგება ვერტიკალურად განლაგებული რვა ჯგუფისგან. თითოეულ მათგანს აქვს ორი ქვეჯგუფი: ძირითადი და მეორადი. ელემენტების ინდიკატორების დასაყენებლად, უნდა იქნას გამოყენებული გარკვეული წესები.
ინსტრუქცია
როგორ გამოვთვალოთ ელემენტების ჟანგვის მდგომარეობა? ცხრილი საშუალებას გაძლევთ სრულად გაუმკლავდეთ მსგავს პრობლემას. ტუტე ლითონები, რომლებიც განლაგებულია პირველ ჯგუფში (მთავარი ქვეჯგუფი), აჩვენებენ ჟანგვის მდგომარეობას ნაერთებში, ის შეესაბამება +, უდრის მათ უმაღლეს ვალენტობას. მეორე ჯგუფის ლითონებს (A ქვეჯგუფი) აქვთ +2 დაჟანგვის მდგომარეობა.
ცხრილი საშუალებას გაძლევთ განსაზღვროთ ეს მნიშვნელობა არა მხოლოდ ელემენტებისთვის, რომლებიც ამჟღავნებენ მეტალის თვისებებს, არამედ არალითონებისთვისაც. მათი მაქსიმალური მნიშვნელობა შეესაბამება უმაღლეს ვალენტობას. მაგალითად, გოგირდისთვის ეს იქნება +6, აზოტისთვის +5. როგორ გამოითვლება მათი მინიმალური (ყველაზე დაბალი) მაჩვენებელი? ცხრილი ასევე პასუხობს ამ კითხვას. გამოვაკლოთ ჯგუფის რიცხვი რვას. მაგალითად, ჟანგბადისთვის ეს იქნება -2, აზოტისთვის -3.
მარტივი ნივთიერებებისთვის, რომლებიც არ შედიოდნენ ქიმიურ ურთიერთქმედებაში სხვა ნივთიერებებთან, განსაზღვრული მაჩვენებელი ითვლება ნულამდე.
შევეცადოთ გამოვყოთ ორობით ნაერთებში განლაგებასთან დაკავშირებული ძირითადი მოქმედებები. როგორ ჩავდოთ მათში დაჟანგვის ხარისხი? პერიოდული ცხრილი დაგეხმარებათ პრობლემის გადაჭრაში.
მაგალითად, აიღეთ კალციუმის ოქსიდი CaO. მეორე ჯგუფის მთავარ ქვეჯგუფში მდებარე კალციუმისთვის მნიშვნელობა იქნება მუდმივი, +2-ის ტოლი. ჟანგბადისთვის, რომელსაც აქვს არამეტალური თვისებები, ეს მაჩვენებელი იქნება უარყოფითი მნიშვნელობა და შეესაბამება -2. განმარტების სისწორის შესამოწმებლად ვაჯამებთ მიღებულ რიცხვებს. შედეგად, ჩვენ ვიღებთ ნულს, შესაბამისად, გამოთვლები სწორია.
განვსაზღვროთ მსგავსი ინდიკატორები კიდევ ერთ ბინარულ ნაერთში CuO. ვინაიდან სპილენძი განლაგებულია მეორად ქვეჯგუფში (პირველი ჯგუფი), შესაბამისად, შესასწავლი მაჩვენებელი შეიძლება აჩვენოს სხვადასხვა მნიშვნელობა. ამიტომ, მის დასადგენად, ჯერ უნდა დაადგინოთ ჟანგბადის მაჩვენებელი.
ბინარული ფორმულის ბოლოს მდებარე არალითონისთვის, ჟანგვის მდგომარეობას აქვს უარყოფითი მნიშვნელობა. ვინაიდან ეს ელემენტი მეექვსე ჯგუფშია, რვადან ექვსის გამოკლებისას ვიღებთ, რომ ჟანგბადის ჟანგვის მდგომარეობა შეესაბამება -2-ს. ვინაიდან ნაერთში არ არის ინდექსები, შესაბამისად, სპილენძის ჟანგვის მდგომარეობა დადებითი იქნება, +2-ის ტოლი.
სხვაგვარად როგორ გამოიყენება ქიმიის ცხრილი? სამი ელემენტისგან შემდგარ ფორმულებში ელემენტების ჟანგვის მდგომარეობა ასევე გამოითვლება გარკვეული ალგორითმის მიხედვით. პირველი, ეს ინდიკატორები მოთავსებულია პირველ და ბოლო ელემენტზე. პირველ რიგში, ამ ინდიკატორს ექნება დადებითი მნიშვნელობა, შეესაბამება ვალენტობას. უკიდურესი ელემენტისთვის, რომელიც არის არალითონი, ამ ინდიკატორს აქვს უარყოფითი მნიშვნელობა, იგი განისაზღვრება როგორც განსხვავება (ჯგუფის რიცხვი გამოკლებულია რვადან). ცენტრალური ელემენტის ჟანგვის მდგომარეობის გაანგარიშებისას გამოიყენება მათემატიკური განტოლება. გამოთვლები ითვალისწინებს თითოეული ელემენტისთვის ხელმისაწვდომ ინდექსებს. ყველა ჟანგვის მდგომარეობის ჯამი უნდა იყოს ნული.
გოგირდის მჟავაში განსაზღვრის მაგალითი
ამ ნაერთის ფორმულა არის H 2 SO 4 . წყალბადს აქვს ჟანგვის მდგომარეობა +1, ჟანგბადს აქვს -2. გოგირდის ჟანგვის მდგომარეობის დასადგენად ვადგენთ მათემატიკურ განტოლებას: + 1 * 2 + X + 4 * (-2) = 0. ვიღებთ, რომ გოგირდის ჟანგვის მდგომარეობა შეესაბამება +6-ს.
დასკვნა
წესების გამოყენებისას შეგიძლიათ დაალაგოთ კოეფიციენტები რედოქს რეაქციებში. ეს საკითხი განიხილება სასკოლო სასწავლო გეგმის მეცხრე კლასის ქიმიის კურსში. გარდა ამისა, ინფორმაცია დაჟანგვის ხარისხების შესახებ საშუალებას გაძლევთ შეასრულოთ OGE და ერთიანი სახელმწიფო გამოცდის დავალებები.
ჟანგვის ხარისხი. ელემენტის ატომის დაჟანგვის მდგომარეობის განსაზღვრა ნაერთის ქიმიური ფორმულით. ნაერთის ფორმულის შედგენა ელემენტების ატომების ცნობილი ჟანგვის მდგომარეობების მიხედვით
ელემენტის დაჟანგვის მდგომარეობა არის ატომის პირობითი მუხტი ნივთიერებაში, გამოითვლება იმ ვარაუდით, რომ იგი შედგება იონებისგან. ელემენტების დაჟანგვის ხარისხის დასადგენად, აუცილებელია გახსოვდეთ გარკვეული წესები:
1. დაჟანგვის მდგომარეობა შეიძლება იყოს დადებითი, უარყოფითი ან ნულოვანი. იგი აღინიშნება არაბული რიცხვიპლიუს ან მინუს ნიშნით ელემენტის სიმბოლოს ზემოთ.
2. დაჟანგვის მდგომარეობების განსაზღვრისას ისინი გამოდიან ნივთიერების ელექტრონეგატიურობიდან: ნაერთში ყველა ატომის ჟანგვის მდგომარეობების ჯამი არის ნული.
3. თუ ნაერთი წარმოიქმნება ერთი ელემენტის ატომებით (მარტივ ნივთიერებაში), მაშინ ამ ატომების ჟანგვის მდგომარეობა ნულის ტოლია.
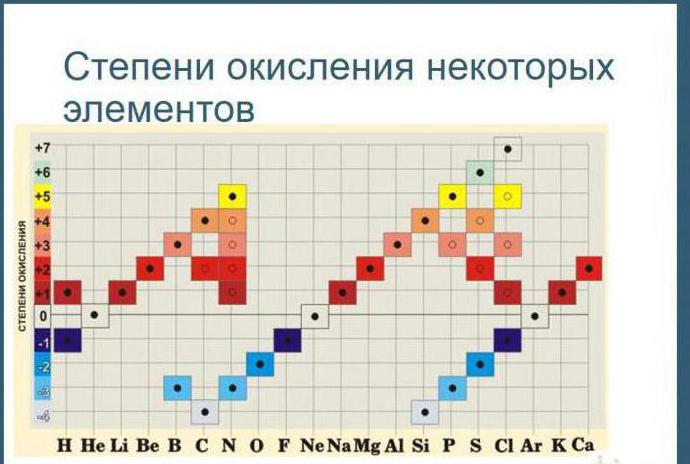
4. ზოგიერთი ქიმიური ელემენტის ატომებს ჩვეულებრივ ენიჭებათ დაჟანგვის მდგომარეობა ფოლადისთვის. მაგალითად, ნაერთებში ფტორის ჟანგვის მდგომარეობა ყოველთვის არის -1; ლითიუმი, ნატრიუმი, კალიუმი, რუბიდიუმი და ცეზიუმი +1; მაგნიუმი, კალციუმი, სტრონციუმი, ბარიუმი და თუთია +2, ალუმინი +3.
5. წყალბადის ჟანგვის მდგომარეობა ნაერთების უმეტესობაში არის +1 და მხოლოდ ზოგიერთ ლითონთან შემავალ ნაერთებში არის -1-ის ტოლი (KH, BaH 2).
6. ნაერთების უმეტესობაში ჟანგბადის დაჟანგვის მდგომარეობა არის -2 და მხოლოდ ზოგიერთ ნაერთს ენიჭება -1 ჟანგვის მდგომარეობა (H 2 O 2 , Na 2 O 2 ან +2 (OF 2).
7. მრავალი ქიმიური ელემენტის ატომები ავლენენ ცვალებად ჟანგვის მდგომარეობას.
8. ნაერთებში ლითონის ატომის ჟანგვის მდგომარეობა დადებითია და რიცხობრივად ტოლია მის ვალენტობას.
9. ელემენტის მაქსიმალური დადებითი დაჟანგვის მდგომარეობა ჩვეულებრივ უდრის ჯგუფის რიცხვს პერიოდულ სისტემაში, რომელშიც ელემენტი მდებარეობს.
10. ლითონების მინიმალური დაჟანგვის მდგომარეობა არის ნული. არალითონებისთვის, უმეტეს შემთხვევაში, ქვედა უარყოფითი ჟანგვის მდგომარეობა უდრის სხვაობას ჯგუფის რიცხვსა და რვა რიცხვს შორის.
11. ატომის დაჟანგვის მდგომარეობა ქმნის მარტივ იონს (ერთი ატომისგან შედგება), ამ იონის მუხტის ტოლი.
ზემოაღნიშნული წესების გამოყენებით, ჩვენ განვსაზღვრავთ ქიმიური ელემენტების ჟანგვის მდგომარეობებს H 2 SO 4-ის შემადგენლობაში. ეს არის რთული ნივთიერება, რომელიც შედგება სამი ქიმიური ელემენტისგან - წყალბადი H, გოგირდი S და ჟანგბადი O. ჩვენ აღვნიშნავთ იმ ელემენტების ჟანგვის მდგომარეობებს, რომლებისთვისაც ისინი მუდმივია. ჩვენს შემთხვევაში, ეს არის წყალბადი H და ჟანგბადი O:.
მოდით განვსაზღვროთ გოგირდის უცნობი ჟანგვის მდგომარეობა. მოდით, ამ ნაერთში გოგირდის დაჟანგვის მდგომარეობა იყოს x:.
მოდით შევქმნათ განტოლებები თითოეული ელემენტისთვის მისი ინდექსის დაჟანგვის მდგომარეობით გამრავლებით და გამოყვანილი რაოდენობა გავუტოლოთ ნულს: 2 (+1) + x + 4 (-2) = 0.
ამრიგად, გოგირდის დაჟანგვის მდგომარეობა არის პლუს ექვსი:.
შემდეგ მაგალითში ჩვენ გავარკვევთ, თუ როგორ შეგიძლიათ დაწეროთ რთული ფორმულა ცნობილი გრადუსებიელემენტის ატომების დაჟანგვა. მოდით შევქმნათ ფერუმის (III) ოქსიდის ფორმულა. სიტყვა „ოქსიდი“ ნიშნავს, რომ რკინის სიმბოლოს მარჯვნივ უნდა ეწეროს ჟანგბადის სიმბოლო: FeO.
გაითვალისწინეთ ქიმიური ელემენტების ჟანგვის მდგომარეობა მათი სიმბოლოების ზემოთ. რკინის ჟანგვის მდგომარეობა მითითებულია სახელში ფრჩხილებში (III), შესაბამისად, ის უდრის +3, ჟანგბადის ჟანგვის მდგომარეობა ოქსიდებში არის -2:.
ვიპოვოთ უმცირესი საერთო ჯერადი 3 და 2 რიცხვებისთვის, ეს არის 6. რიცხვი 6 გავყოთ 3-ზე, მივიღებთ რიცხვს 2 - ეს არის რკინის მაჩვენებელი. გავყოთ რიცხვი 6 2-ზე, მივიღებთ რიცხვს 3 - ეს არის ჟანგბადის მაჩვენებელი:.
შემდეგ მაგალითში გავიგოთ, როგორ ჩამოვაყალიბოთ ნაერთის ფორმულა ელემენტის ატომების და იონური მუხტების ცნობილი ჟანგვის მდგომარეობებით. მოდით გავაკეთოთ კალციუმის ორთოფოსფატის ფორმულა. სიტყვა "ორთოფოსფატი" ნიშნავს, რომ კალციუმის სიმბოლოს მარჯვნივ, ორთოფოსფატის მჟავას მჟავა ნარჩენი უნდა ეწეროს: CaPO 4.
გაითვალისწინეთ კალციუმის ჟანგვის მდგომარეობა (წესი ნომერი მეოთხე) და მჟავა ნარჩენების მუხტი (ხსნადობის ცხრილის მიხედვით):
ვიპოვოთ უმცირესი საერთო ჯერადი 2 და 3 რიცხვებისთვის, ეს არის 6. რიცხვი 6 გავყოთ 2-ზე, მივიღებთ რიცხვს 3 - ეს არის კალციუმის ინდექსი. გავყოთ რიცხვი 6 3-ზე, მივიღებთ რიცხვს 2 - ეს არის მჟავის ნარჩენების მაჩვენებელი:.
ბროლის გისოსები
ბროლის გისოსები. ატომური, მოლეკულური და იონური კრისტალები. ნივთიერებების ფიზიკური თვისებების დამოკიდებულება ბროლის გისოსების ტიპებზე
კრისტალურ ნივთიერებებში ატომები, მოლეკულები და იონები განლაგებულია მოწესრიგებულად, გარკვეულ მანძილზე. ნაწილაკების ასეთ რეგულარულ განლაგებას კრისტალებში ეწოდება ბროლის ბადე. იმისდა მიხედვით, თუ რომელი ნაწილაკებია ამ გისოსის კვანძებში, განასხვავებენ იონურ, ატომურ და მოლეკულურ კრისტალურ გისოსებს. ასევე ცნობილია მეტალის ბროლის გისოსები.
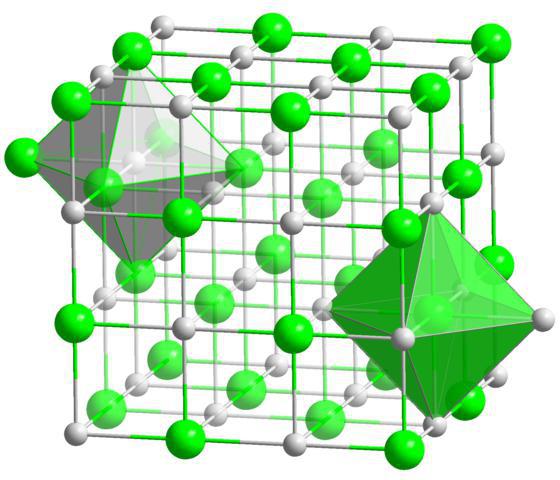
იონური კრისტალური გისოსები დამახასიათებელია იონური ტიპის ქიმიური ბმის მქონე ნაერთებისთვის. ასეთი გისოსების ადგილებში არის საპირისპიროდ დამუხტული იონები. იონთაშორისი ურთიერთქმედების ძალები ძალზე მნიშვნელოვანია, ამიტომ ამ ტიპის კრისტალური მედის მქონე ნივთიერებები არის არამდგრადი, მყარი, ცეცხლგამძლე, მათი ხსნარები და დნობები ატარებენ ელექტრო დენს. ტიპიური წარმომადგენლებიასეთი ნაერთებია მარილები, მაგალითად, ნატრიუმის ქლორიდი, კალიუმის ნიტრატი და სხვა.
ატომური კრისტალური გისოსები დამახასიათებელია ქიმიური ბმის კოვალენტური ტიპის ნაერთებისთვის. ასეთი გისოსების ადგილებში არის ცალკეული ატომები, რომლებიც შეკრულია კოვალენტური ბმებით. ყველა ბმა თანაბარი და ძლიერია, ამიტომ ამ ტიპის კრისტალური მედის მქონე ნივთიერებები ხასიათდება მაღალი სიმტკიცეთ, მაღალი ტემპერატურადნობა, ქიმიური ინერტულობა. ამ ტიპის ბროლის ბადე დამახასიათებელია ალმასის, სილიციუმის (IV) ოქსიდის, ბორის.
მოლეკულური კრისტალური გისოსები დამახასიათებელია ქიმიური ბმის კოვალენტური ტიპის ნაერთებისთვის. ასეთი გისოსების ადგილები შეიცავს არაპოლარულ ან პოლარულ მოლეკულებს. ურთიერთქმედების სუსტი ძალების გამო, ამ ტიპის კრისტალური მედის მქონე ნივთიერებებს აქვთ დაბალი სიმტკიცე, დაბალი დნობის და დუღილის წერტილები და ხასიათდება არასტაბილურობით. ამ ტიპის ბროლის ბადე დამახასიათებელია ჟანგბადის, იოდის, წყლის, გლუკოზის, სპირტების, ნაფთალინისთვის.
ამრიგად, არსებობს გარკვეული კავშირი კრისტალური მედის ტიპსა და ფიზიკური თვისებებინივთიერებები. მაშასადამე, თუ ნივთიერების აგებულება ცნობილია, მაშინ მისი თვისებების პროგნოზირება შესაძლებელია და, პირიქით, თუ ნივთიერების თვისებები ცნობილია, მაშინ მისი სტრუქტურის დადგენა შესაძლებელია.
კოვალენტური ბმა, მისი ტიპები - პოლარული და არაპოლარული
კოვალენტური ბმა, მისი ტიპები - პოლარული და არაპოლარული. კოვალენტური არაპოლარული ბმის ფორმირება. კოვალენტური პოლარული ბმის ფორმირება. ნივთიერებების მოლეკულების ელექტრონული ფორმულები
კოვალენტური ბმაარის ქიმიური ბმა, რომელიც წარმოიქმნება ელექტრონული წყვილების გაზიარებით.
განვიხილოთ კოვალენტური ბმის წარმოქმნის მექანიზმი წყალბადის მოლეკულის H 2 მაგალითის გამოყენებით. წყალბადის ატომებს აქვთ ელექტრონული ფორმულა: 1 H 1s 1 .
როდესაც წყალბადის ორი ატომი ერთმანეთს უახლოვდება, ორი ელექტრონი ანტიპარალელური სპინით (ელექტრონები აღინიშნება ისრებით სხვადასხვა მიმართულებით) ურთიერთქმედებს საერთო (გაზიარებული) ელექტრონული წყვილის წარმოქმნასთან.
კოვალენტური ბმის წარმოქმნის სქემა შეიძლება წარმოდგენილი იყოს გარე დონის დაუწყვილებელი ელექტრონის ერთი წერტილით, ხოლო საერთო ელექტრონული წყვილის ორი წერტილით. საერთო ელექტრონული წყვილი, ე.ი. კოვალენტური ბმა, რომელიც ხშირად აღინიშნება ზოლით. საერთო ელექტრონული წყვილი წარმოიქმნება წყალბადის ატომების s-ორბიტალების გადაფარვის შედეგად, ხოლო ელექტრონის გაზრდილი სიმკვრივე იქმნება გადახურვის ორბიტალების რეგიონში.
განვიხილოთ კოვალენტური ბმის წარმოქმნა ქლორის Cl2 მოლეკულაში. ქლორის ატომებს აქვთ ელექტრონული ფორმულა: 17 Cl 1s 2 2s 2 2p 6 3s 2 3p 5.
ქლორის ატომს აქვს შვიდი ელექტრონი მის გარე ენერგეტიკულ დონეზე, ერთი დაუწყვილებელი ელექტრონი 3p ქვედონეებში. ქლორის ორი ატომის გაერთიანებისას, 3p ორბიტალი გადაფარავს დაუწყვილებელ ელექტრონებს და წარმოიქმნება საერთო ელექტრონული წყვილი. Cl 2 მოლეკულაში ქლორის თითოეული ატომი ინახავს სამ გაუზიარებელ ელექტრონულ წყვილს (რომლებიც ერთ ატომს ეკუთვნის).
წყალბადის H2 მოლეკულაში, ისევე როგორც ქლორის მოლეკულაში Cl 2, იქმნება მარტივი (ერთჯერადი) ბმა. არის მოლეკულები, რომლებშიც ორი ან სამი ელექტრონული წყვილი ჩნდება ორ ატომს შორის. ასეთ კოვალენტურ ბმებს, შესაბამისად, ორმაგი ან სამმაგი ეწოდება. ორმაგი და სამმაგი ობლიგაციების საერთო სახელწოდებაა მრავალი ბმა.
მაგალითად, განვიხილოთ კოვალენტური ბმის წარმოქმნა ჟანგბადის მოლეკულაში O 2 . ჟანგბადის ატომებს აქვთ ელექტრონული ფორმულა: 8 O 1s 2 2s 2 2p 4.
ჟანგბადის ატომს აქვს ექვსი ელექტრონი მის გარე ენერგეტიკულ დონეზე, ორი დაუწყვილებელი ელექტრონი 2p ქვედონეებში. O 2 მოლეკულაში ქიმიური ბმის ფორმირებაში მონაწილეობს ჟანგბადის თითოეული ატომის ორი ელექტრონი. IN ამ საქმესწარმოიქმნება ორი საერთო ელექტრონული წყვილი (ორმაგი ბმა). O 2 მოლეკულაში ჟანგბადის თითოეული ატომი ინახავს ორ გაუზიარებელ ელექტრონულ წყვილს.
როდესაც წყალბადის მოლეკულაში წარმოიქმნება კოვალენტური ბმა, წყალბადის თითოეული ატომი არის სტაბილური ორელექტრონული კონფიგურაცია საერთო ელექტრონული წყვილის წარმოქმნის გამო. სხვა შემთხვევებში, როდესაც კოვალენტური ბმა იქმნება, მაგალითად, ქლორისა და ჟანგბადის მოლეკულებში, თითოეული ატომი არის სტაბილური კონფიგურაცია, რომელიც შედგება რვა ელექტრონისაგან.
სამივე განხილული მოლეკულის შემთხვევაში (წყალბადი, ქლორი და ჟანგბადი), წარმოიქმნა კოვალენტური ბმა ერთი და იგივე ელექტრონეგატიურობის მქონე ატომებს შორის. ასეთი ურთიერთქმედება შეინიშნება მარტივი არალითონური ნივთიერებების წარმოქმნის დროს, რომელთა მოლეკულები შედგება ორი იდენტური ატომისგან. ამ შემთხვევაში, საერთო ელექტრონული წყვილი განლაგებულია სიმეტრიულად ატომების ბირთვებს შორის, ისინი დაკავშირებულია. შედეგად წარმოიქმნება მოლეკულები, რომლებშიც დადებითი და უარყოფითი მუხტების ცენტრები ერთმანეთს ემთხვევა.
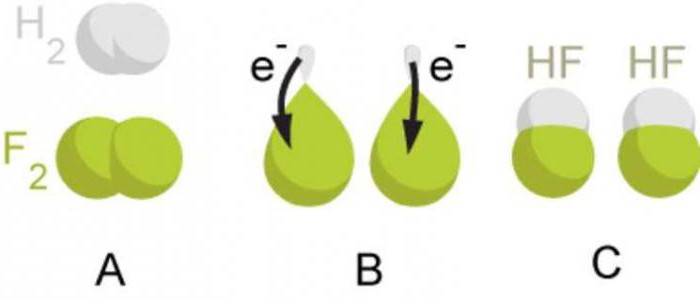
ასე რომ, კოვალენტურ კავშირს, რომელიც წარმოიქმნება ერთი და იგივე ელექტრონეგატიურობის მქონე ატომებს შორის საერთო ელექტრონული წყვილების გამო, ეწოდება კოვალენტური არაპოლარული ბმა. უნდა გვახსოვდეს, რომ ამ ტიპის ქიმიური ბმა იქმნება მარტივ არამეტალურ ნივთიერებებში. კოვალენტური არაპოლარული ტიპის ბმის მქონე ნივთიერებების მაგალითებად შეიძლება დავასახელოთ ფტორი F 2, ბრომი Br 2, იოდი I 2, აზოტი N 2.
თუ ურთიერთქმედება ატომებს აქვთ განსხვავებული ელექტრონეგატიურობა (სხვადასხვა ქიმიური ელემენტის ატომები), მაშინ საერთო ელექტრონული წყვილი გადაინაცვლებს ატომისკენ უფრო დიდი ელექტრონეგატიურობით. ამ შემთხვევაში, ატომზე წარმოიქმნება ნაწილობრივი უარყოფითი მუხტი უფრო მაღალი ელექტროუარყოფითობის მქონე ატომზე, ხოლო ნაწილობრივი დადებითი მუხტი წარმოიქმნება დაბალი ელექტრონეგატიურობის ატომზე. ეს ნაწილობრივი მუხტები აბსოლუტური მნიშვნელობით ერთიანობაზე ნაკლებია.
მაგალითად, როდესაც იქმნება წყალბადის ქლორიდის მოლეკულა HCl, წყალბადის ატომის s-ორბიტალი და ქლორის ატომის p-ორბიტალი ერთმანეთს ემთხვევა. საერთო ელექტრონული წყვილი განლაგებულია ასიმეტრიულად ურთიერთმოქმედ ატომების ცენტრებთან მიმართებაში. ის გადადის უფრო ელექტროუარყოფით ქლორზე. ქლორის ატომს აქვს ნაწილობრივი უარყოფითი მუხტი, ხოლო წყალბადის ატომს აქვს ნაწილობრივი დადებითი მუხტი. ამ შემთხვევაში მოლეკულაში დადებითი და უარყოფითი მუხტების ცენტრები ერთმანეთს არ ემთხვევა. ასეთ მოლეკულებს პოლარული ანუ დიპოლები ეწოდება. დიპოლი არის ორი მუხტის სისტემა, რომლებიც ტოლია სიდიდით, მაგრამ საპირისპირო ნიშნით.
ასე რომ, კოვალენტურ კავშირს, რომელიც იქმნება ატომებს შორის, რომელთა ელექტრონეგატიურობა განსხვავებულია, მაგრამ ოდნავ, ეწოდება კოვალენტური პოლარული ბმა. უნდა გვახსოვდეს, რომ ამ ტიპის ქიმიური ბმა იქმნება რთულ ნივთიერებებში, რომლებიც წარმოიქმნება არალითონის ატომებით. კოვალენტური პოლარული ტიპის ბმის მქონე ნივთიერებების მაგალითებად შეიძლება დავასახელოთ წყალბადის ფტორი HF, წყალი H 2 O, ამიაკი NH 3, მეთანი CH 4, ნახშირბადის (IV) ოქსიდი CO 2.
იონური ბმა იქმნება ერთი ან მეტი ელექტრონის სრული გადაცემით ერთი ატომიდან მეორეზე. ამ ტიპის კავშირი შესაძლებელია მხოლოდ ელემენტების ატომებს შორის, რომელთა ელექტრონეგატიურობა მნიშვნელოვნად განსხვავდება. ამ შემთხვევაში ელექტრონი მოძრაობს უფრო დაბალი ელექტრონეგატიურობის ატომიდან უფრო მაღალი ელექტრონეგატიურობის ატომში. უნდა გვახსოვდეს, რომ ამ ტიპის ქიმიური ბმა იქმნება ლითონებისა და არამეტალების ატომებს შორის. მაგალითად, ძირითადი ქვეჯგუფების პირველი და მეორე ჯგუფის ელემენტები პერიოდული სისტემა(ტიპიური ლითონები) უშუალოდ შერწყმულია პერიოდული სისტემის ძირითადი ქვეჯგუფების მეექვსე და მეშვიდე ჯგუფის ელემენტებთან (ტიპიური არამეტალები).
განვიხილოთ იონური ბმის წარმოქმნის მექანიზმი კალიუმის ქლორიდის შემადგენლობაში. კალიუმის ატომი შეიცავს ერთ ვალენტურ ელექტრონს (განისაზღვრება იმ ჯგუფის რაოდენობით, რომელშიც მდებარეობს კალიუმი). ქლორის ატომი შეიცავს შვიდ ვალენტურ ელექტრონს (განისაზღვრება იმ ჯგუფის რაოდენობით, რომელშიც ქლორი მდებარეობს). როდესაც კალიუმის ატომები ქლორის ატომებთან ურთიერთქმედებენ, კალიუმის ატომის ვალენტური ელექტრონი მთლიანად გადადის ქლორის ატომის გარე დონეზე, სრულდება მას რვა ელექტრონის სტრუქტურაში. ამ შემთხვევაში, კალიუმის ატომი, კარგავს ელექტრონს, იძენს დადებით მუხტს +1 და გადაიქცევა K + კატიონად, ხოლო ქლორის ატომი, ელექტრონის დამატებით, იძენს უარყოფით მუხტს -1 და გადაიქცევა ანიონად Cl - . საპირისპიროდ დამუხტული იონები ელექტროსტატიკური ძალების გამო იზიდავს და წარმოიქმნება ნაერთი კალიუმის ქლორიდი. ეს პროცესი შეიძლება წარმოდგენილი იყოს დიაგრამით:
მხოლოდ ზოგიერთი ქიმიური ელემენტი (კეთილშობილი აირები) ნორმალურ პირობებში არის მონოტომიური აირის მდგომარეობაში. სხვა ელემენტების ატომები, პირიქით, არ არსებობს ინდივიდუალურად, მაგრამ არის მოლეკულების ან კრისტალური გისოსების ნაწილი, რომელიც წარმოიქმნება ატომების კომბინაციით. ასე რომ, არსებობს მიზეზი, რის გამოც ატომები აკავშირებენ ერთმანეთს. ეს მიზეზი არის ქიმიური კავშირი, იმის გამო, რომ ატომებს შორის არის გარკვეული ელექტროსტატიკური ძალები, რომლებსაც შეუძლიათ ატომების ერთმანეთთან შეკავება. დადასტურებულია, რომ ატომებს შორის ქიმიური ბმის წარმოქმნისას მთავარი როლიმიეკუთვნება ვალენტურ ელექტრონებს (გარე დონის ელექტრონები, სუსტად ასოცირებული ბირთვთან).
ქიმიური კავშირის თეორიის მიხედვით, ორი ან რვა ელექტრონისაგან შემდგარ გარე გარსებს აქვთ ყველაზე დიდი ძალა. კეთილშობილ გაზებს ასეთი ელექტრონული გარსები აქვთ. ეს არის მიზეზი იმისა, რომ კეთილშობილი აირები ნორმალურ პირობებში არ შედიან ქიმიურ რეაქციებში სხვა ელემენტებთან. ატომები, რომელთა გარე დონეზე რვა (ან ორზე) ელექტრონიზე ნაკლებია, ცდილობენ მიიღონ კეთილშობილური აირის სტრუქტურა. ამიტომ, როდესაც ქიმიური რეაქციის დროს წარმოიქმნება მოლეკულა, ატომები ცდილობენ მიიღონ სტაბილური რვა ელექტრონი ან ორელექტრონული გარსი.
სტაბილური ელექტრონული კონფიგურაციის ფორმირება შეიძლება მოხდეს რამდენიმე გზით და გამოიწვიოს სხვადასხვა სტრუქტურის მოლეკულების ან არამოლეკულური ნაერთების წარმოქმნა. შედეგად, განასხვავებენ ქიმიურ ბმების კოვალენტურ და იონურ ტიპებს. ამ ტიპების გარდა, არსებობს სხვა სახის ქიმიური ბმები: მეტალის და წყალბადის (ინტერმოლეკულური).
ნაერთებში ატომის ფორმალური მუხტი არის დამხმარე სიდიდე, ის ჩვეულებრივ გამოიყენება ქიმიაში ელემენტების თვისებების აღწერისას. ეს პირობითი ელექტრული მუხტი არის დაჟანგვის ხარისხი. მისი ღირებულება იცვლება მრავალი ქიმიური პროცესის შედეგად. მიუხედავად იმისა, რომ მუხტი ფორმალურია, ის ნათლად ახასიათებს ატომების თვისებებს და ქცევას რედოქს რეაქციებში (ORDs).
დაჟანგვა და შემცირება
წარსულში ქიმიკოსები იყენებდნენ ტერმინს „დაჟანგვა“ სხვა ელემენტებთან ჟანგბადის ურთიერთქმედების აღსაწერად. რეაქციების სახელწოდება მომდინარეობს ჟანგბადის ლათინური სახელიდან - Oxygenium. მოგვიანებით გაირკვა, რომ სხვა ელემენტებიც იჟანგება. ამ შემთხვევაში ისინი აღდგება - ამაგრებენ ელექტრონებს. თითოეული ატომი მოლეკულის წარმოქმნის დროს ცვლის მისი ვალენტური ელექტრონული გარსის სტრუქტურას. ამ შემთხვევაში ჩნდება ფორმალური მუხტი, რომლის ღირებულება დამოკიდებულია პირობითად მოცემული ან მიღებული ელექტრონების რაოდენობაზე. ამ მნიშვნელობის დასახასიათებლად ადრე გამოიყენებოდა ინგლისური ქიმიური ტერმინი „ჟანგვის ნომერი“, რაც თარგმანში „ჟანგვის რიცხვს“ ნიშნავს. მისი გამოყენებისას ისინი გამომდინარეობენ იმ ვარაუდიდან, რომ მოლეკულებში ან იონებში შემაკავშირებელი ელექტრონები ეკუთვნის ატომს, რომელსაც აქვს მეტი მაღალი ღირებულებაელექტრონეგატიურობა (EO). მათი ელექტრონების შენარჩუნებისა და სხვა ატომებიდან მათი მოზიდვის უნარი კარგად არის გამოხატული ძლიერ არამეტებში (ჰალოგენები, ჟანგბადი). ძლიერ ლითონებს (ნატრიუმს, კალიუმს, ლითიუმს, კალციუმს, სხვა ტუტე და დედამიწის ტუტე ელემენტებს) აქვთ საპირისპირო თვისებები.
ჟანგვის ხარისხის განსაზღვრა
ჟანგვის მდგომარეობა არის მუხტი, რომელსაც ატომი შეიძენს, თუ ბმის ფორმირებაში მონაწილე ელექტრონები მთლიანად გადაინაცვლებენ უფრო ელექტროუარყოფით ელემენტზე. არის ნივთიერებები, რომლებსაც არ აქვთ მოლეკულური სტრუქტურა (ტუტე ლითონის ჰალოგენები და სხვა ნაერთები). ამ შემთხვევებში, ჟანგვის მდგომარეობა ემთხვევა იონის მუხტს. პირობითი ან რეალური მუხტი გვიჩვენებს, თუ რა პროცესი მიმდინარეობდა ატომების ამჟამინდელ მდგომარეობამდე. დადებითი დაჟანგვის მდგომარეობა არის ელექტრონების მთლიანი რაოდენობა, რომლებიც ამოღებულია ატომებიდან. უარყოფითი მნიშვნელობაჟანგვის მდგომარეობა უდრის შეძენილი ელექტრონების რაოდენობას. ქიმიური ელემენტის ჟანგვის მდგომარეობის შეცვლით, განსჯის რა ხდება მის ატომებს რეაქციის დროს (და პირიქით). ნივთიერების ფერი განსაზღვრავს რა ცვლილებები მოხდა ჟანგვის მდგომარეობაში. ქრომის, რკინისა და რიგი სხვა ელემენტების ნაერთები, რომლებშიც ისინი სხვადასხვა ვალენტობას ავლენენ, განსხვავებული ფერისაა.
უარყოფითი, ნულოვანი და დადებითი დაჟანგვის მდგომარეობის მნიშვნელობები

წარმოიქმნება მარტივი ნივთიერებები ქიმიური ელემენტებითან იგივე ღირებულება EO. ამ შემთხვევაში, შემაკავშირებელი ელექტრონები თანაბრად ეკუთვნის ყველა სტრუქტურულ ნაწილაკს. ამიტომ მარტივ ნივთიერებებში ჟანგვის მდგომარეობა (H 0 2, O 0 2, C 0) არ არის დამახასიათებელი ელემენტებისთვის. როდესაც ატომები იღებენ ელექტრონებს ან ზოგადი ღრუბელი გადაინაცვლებს მათ მიმართულებით, ჩვეულებრივია მუხტების დაწერა მინუს ნიშნით. მაგალითად, F -1, O -2, C -4. ელექტრონების შემოწირულობით, ატომები იძენენ რეალურ ან ფორმალურ დადებით მუხტს. OF 2 ოქსიდში, ჟანგბადის ატომი აძლევს თითო ელექტრონს ფტორის ორ ატომს და იმყოფება O +2 ჟანგვის მდგომარეობაში. ითვლება, რომ მოლეკულაში ან პოლიატომურ იონში, უფრო ელექტროუარყოფითი ატომები იღებენ ყველა შემაკავშირებელ ელექტრონს.
გოგირდი არის ელემენტი, რომელიც ავლენს სხვადასხვა ვალენტობას და ჟანგვის მდგომარეობას.
ძირითადი ქვეჯგუფების ქიმიური ელემენტები ხშირად ავლენენ VIII-ის ტოლი ქვედა ვალენტობას. მაგალითად, გოგირდის ვალენტობა წყალბადის სულფიდში და ლითონის სულფიდებში არის II. ელემენტს ახასიათებს შუალედური და მაღალი ვალენტობები აღგზნებულ მდგომარეობაში, როდესაც ატომი თმობს ერთ, ორ, ოთხ ან ექვსივე ელექტრონს და ავლენს შესაბამისად I, II, IV, VI ვალენტობას. იგივე მნიშვნელობები, მხოლოდ მინუს ან პლუს ნიშნით, აქვს გოგირდის დაჟანგვის მდგომარეობა:
- ფტორის სულფიდში იძლევა ერთ ელექტრონს: -1;
- წყალბადის სულფიდში ყველაზე დაბალი მნიშვნელობა: -2;
- დიოქსიდის შუალედურ მდგომარეობაში: +4;
- ტრიოქსიდში, გოგირდმჟავასა და სულფატებში: +6.
უმაღლესი ჟანგვის მდგომარეობაში გოგირდი მხოლოდ ელექტრონებს იღებს, ყველაზე დაბალ მდგომარეობაში კი ავლენს ძლიერ შემცირების თვისებებს. S +4 ატომებს შეუძლიათ იმოქმედონ როგორც აღმდგენი ან ჟანგვის აგენტები ნაერთებში, პირობებიდან გამომდინარე.
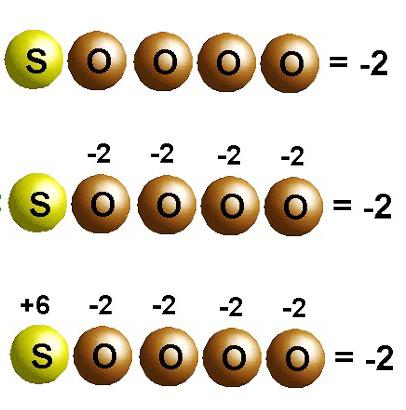
ელექტრონების გადაცემა ქიმიურ რეაქციებში
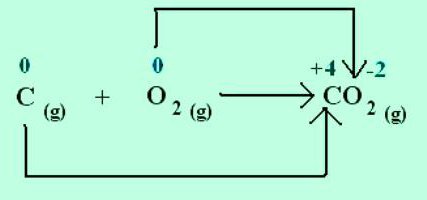
ნატრიუმის ქლორიდის კრისტალის ფორმირებისას, ნატრიუმი ელექტრონებს აძლევს უფრო ელექტროუარყოფით ქლორს. ელემენტების ჟანგვის მდგომარეობები ემთხვევა იონების მუხტს: Na +1 Cl -1 . ელექტრონული წყვილების სოციალიზაციისა და გადაადგილების შედეგად შექმნილი მოლეკულებისთვის უფრო ელექტროუარყოფით ატომში გამოიყენება მხოლოდ ფორმალური მუხტის კონცეფცია. მაგრამ შეიძლება ვივარაუდოთ, რომ ყველა ნაერთი შედგება იონებისგან. შემდეგ ატომები ელექტრონების მიზიდვით იძენენ პირობით უარყოფით მუხტს, გაცემით კი დადებითს. რეაქციებში მიუთითეთ რამდენი ელექტრონი არის გადაადგილებული. მაგალითად, ნახშირორჟანგის მოლეკულაში C +4 O - 2 2, ნახშირბადის ქიმიური სიმბოლოს ზედა მარჯვენა კუთხეში მითითებული ინდექსი აჩვენებს ატომიდან ამოღებული ელექტრონების რაოდენობას. ამ ნივთიერებაში ჟანგბადს აქვს -2 ჟანგვის მდგომარეობა. შესაბამისი ინდექსი ქიმიური ნიშნით O არის ატომში დამატებული ელექტრონების რაოდენობა.
როგორ გამოვთვალოთ ჟანგვის მდგომარეობა
ატომების მიერ შემოწირული და დამატებული ელექტრონების რაოდენობის დათვლა შეიძლება შრომატევადი იყოს. შემდეგი წესები ამარტივებს ამ ამოცანას:
- მარტივ ნივთიერებებში ჟანგვის მდგომარეობა ნულის ტოლია.
- ნეიტრალურ ნივთიერებაში ყველა ატომის ან იონის დაჟანგვის ჯამი არის ნული.
- კომპლექსურ იონში ყველა ელემენტის ჟანგვის მდგომარეობების ჯამი უნდა შეესაბამებოდეს მთელი ნაწილაკების მუხტს.
- უფრო ელექტროუარყოფითი ატომი იძენს უარყოფით ჟანგვის მდგომარეობას, რომელიც იწერება მინუს ნიშნით.
- ნაკლებად ელექტროუარყოფითი ელემენტები იღებენ დადებით ჟანგვის მდგომარეობებს, ისინი იწერება პლუს ნიშნით.
- ჟანგბადი ზოგადად ავლენს ჟანგვის მდგომარეობას -2.
- წყალბადისთვის დამახასიათებელი ღირებულება: +1, გვხვდება ლითონის ჰიდრიდებში: H-1.
- ფტორი არის ყველაზე ელექტროუარყოფითი ყველა ელემენტიდან, მისი დაჟანგვის მდგომარეობა ყოველთვის -4-ია.
- მეტალების უმეტესობისთვის ჟანგვის რიცხვი და ვალენტობა იგივეა.

ჟანგვის მდგომარეობა და ვალენტობა
ნაერთების უმეტესობა წარმოიქმნება რედოქსის პროცესების შედეგად. ელექტრონების გადასვლა ან გადაადგილება ერთი ელემენტიდან მეორეზე იწვევს მათი დაჟანგვის მდგომარეობისა და ვალენტობის ცვლილებას. ხშირად ეს ღირებულებები ემთხვევა. ტერმინის „დაჟანგვის მდგომარეობის“ სინონიმად შეიძლება გამოვიყენოთ ფრაზა „ელექტროქიმიური ვალენტობა“. მაგრამ არსებობს გამონაკლისები, მაგალითად, ამონიუმის იონში აზოტი ოთხვალენტიანია. ამავდროულად, ამ ელემენტის ატომი არის ჟანგვის მდგომარეობაში -3. ორგანულ ნივთიერებებში ნახშირბადი ყოველთვის ოთხვალენტიანია, მაგრამ C ატომის ჟანგვის მდგომარეობებს მეთანში CH 4, ფორმულ სპირტს CH 3 OH და HCOOH მჟავას აქვს განსხვავებული მნიშვნელობები: -4, -2 და +2.
რედოქსის რეაქციები

ბევრი რედოქსი კრიტიკული პროცესებიინდუსტრიაში, ტექნოლოგიაში, ცხოვრებასა და უსულო ბუნება: წვა, კოროზია, დუღილი, უჯრედშიდა სუნთქვა, ფოტოსინთეზი და სხვა მოვლენები.
OVR განტოლებების შედგენისას კოეფიციენტები შეირჩევა ელექტრონული ბალანსის მეთოდით, რომელშიც მოქმედებს შემდეგი კატეგორიები:
- ჟანგვის მდგომარეობები;
- შემცირების აგენტი აძლევს ელექტრონებს და იჟანგება;
- ჟანგვის აგენტი იღებს ელექტრონებს და მცირდება;
- მოცემული ელექტრონების რაოდენობა უნდა იყოს მიმაგრებული ელექტრონების რაოდენობის ტოლი.
ატომის მიერ ელექტრონების მიღება იწვევს მისი დაჟანგვის მდგომარეობის შემცირებას (შემცირებას). ატომის მიერ ერთი ან მეტი ელექტრონის დაკარგვას თან ახლავს ელემენტების ჟანგვის რაოდენობის ზრდა რეაქციების შედეგად. OVR-სთვის, წყალხსნარებში ძლიერი ელექტროლიტების იონებს შორის მიედინება, უფრო ხშირად გამოიყენება არა ელექტრონული ბალანსი, არამედ ნახევრად რეაქციების მეთოდი.
შეიძლება სასარგებლო იყოს წაკითხვა:
- წმიდა მიროს მატარებელი ქალების დღე;
- ვნების მატარებელი ევგენი ბოტკინი მოწამე ევგენი ბოტკინი;
- სასულიერო რეპი: ჩუვაშური "ოხლობისტინი" ასწავლის მოზარდებს სიყვარულსა და თავმდაბლობას რეჩიტატივით;
- ეპარქიული მისიონერული კურსები: ლექცია პროტოდიაკონის მისიონერულ მოღვაწეობაზე ა;
- როგორ გავიგოთ, რა მოსწონს მორიელს;
- Zombie Apocalypse ონლაინ მეგობრებთან ერთად;
- ონლაინ თამაშები Zombie Apocalypse თამაში;
- პრობლემები ფიფას თამაშის დაწყებასთან დაკავშირებით;